qPCR 실험에서 프라이머 디자인도 매우 중요한 연결 고리입니다.프라이머의 적합 여부는 증폭 효율이 기준에 도달했는지, 증폭된 산물이 특이적인지, 실험 결과가 있는지 여부와 밀접한 관련이 있습니다.
그렇다면 qPCR 프라이머 특이성을 개선하는 방법은 무엇일까요?높은 증폭 효율?
오늘은 함께 qPCR 프라이머를 설계하고, qPCR 프라이머 설계가 실험에서 효율적인 지식 기술이 되도록 안내해드리겠습니다.
qPCR primer를 디자인할 때 일반적으로 다음 사항에 주의해야 합니다. primer는 최대한 intron을 가로질러 디자인해야 하고, product length는 100-300 bp, Tm 값은 60°C에 최대한 근접해야 하고, upstream과 downstream primer는 최대한 가까워야 하고, primer의 끝은 G 또는 C 등이 되어야 합니다.
1. 인트론에 걸친 프라이머 설계
qPCR 프라이머를 디자인할 때 인트론에 걸쳐 디자인된 프라이머를 선택하면 gDNA 템플릿이 증폭되는 것을 방지할 수 있으며 제품은 모두 cDNA의 증폭에서 파생되므로 gDNA 오염의 영향을 제거합니다.
2. 프라이머 길이
프라이머 길이는 일반적으로 18-30 nt 사이이며 증폭 산물의 길이는 가능한 한 100-300 bp 사이에서 제어되어야 합니다.
프라이머가 너무 짧으면 비특이적 증폭으로 이어지고, 너무 길면 2차 구조(예: 헤어핀 구조)를 형성하기 쉽습니다.증폭 산물이 너무 길면 중합 효소 반응에 적합하지 않아 PCR 증폭 효율에 영향을 미칩니다.
3. GC 함량 및 Tm 값
프라이머의 GC 함량은 40%에서 60% 사이로 제어되어야 합니다.너무 높거나 너무 낮으면 반응을 시작하는 데 도움이 되지 않습니다.정방향 및 역방향 프라이머의 GC 함량은 동일한 Tm 값 및 어닐링 온도를 얻기 위해 동일에 가까워야 합니다.
Tm 값은 가능한 한 55-65°C 사이, 일반적으로 약 60°C여야 하며 상류와 하류의 Tm 값은 가능한 한 가까워야 하며 바람직하게는 4°C를 넘지 않아야 합니다.
4. 프라이머의 3' 말단에서 A를 선택하지 마십시오.
프라이머의 3' 말단이 일치하지 않을 때, 서로 다른 염기의 합성 효율에 큰 차이가 있습니다.마지막 염기가 A일 때 미스매치인 경우에도 체인 합성을 개시할 수 있고, 마지막 염기가 T일 때 미스매치 유도 효율이 크게 떨어진다.따라서 프라이머의 3' 말단에서 A를 선택하는 것을 피하고 T를 선택하는 것이 좋습니다.
프로브 프라이머인 경우 프로브의 5' 말단은 G가 될 수 없습니다. 단일 G 염기가 FAM 형광 리포터 그룹에 연결되어 있어도 G는 FAM 그룹에서 방출되는 형광 신호를 소멸시킬 수 있기 때문에 위음성 결과가 나올 수 있습니다.나타나다.
5. 기본 분포
프라이머에서 4개 염기의 분포는 바람직하게는 무작위이며, 3' 말단에서 3개 이상의 연속적인 G 또는 C 및 3개 이상의 연속적인G 또는 C는 GC가 풍부한 시퀀스 영역에서 페어링을 생성하기 쉽습니다.
6. 프라이머 디자인 영역은 복잡한 2차 구조를 피해야 합니다.
증폭 산물의 단일 가닥에 의해 형성된 2차 구조는 PCR의 원활한 진행에 영향을 미칩니다.표적 서열에 2차 구조가 있는지 미리 예측하여 프라이머 디자인에서 이 영역을 피하십시오.
7. 프라이머 자체와 프라이머 사이는 연속적인 상보적인 염기를 피해야 합니다.
프라이머 자체와 프라이머 사이에 연속적인 4개의 염기 상보성이 있을 수 없습니다.프라이머 자체는 상보적 서열을 가지지 않아야 하며, 그렇지 않으면 자체적으로 접혀서 헤어핀 구조를 형성하게 되며, 이는 프라이머와 템플릿의 어닐링 조합에 영향을 미칩니다.
상보적 서열은 상류 프라이머와 하류 프라이머 사이에 존재할 수 없습니다.프라이머 사이의 상보성은 PCR 효율을 감소시키고 정량적 정확도에도 영향을 미치는 프라이머 다이머를 생성합니다.primer-dimer와 hairpin 구조가 불가피한 경우 △G 값이 너무 높지 않아야 합니다(4.5kcal/mol 미만).
8. 프라이머는 표적 특정 제품을 증폭합니다.
qPCR 검출의 궁극적인 목표는 표적 유전자의 풍부함을 이해하는 것입니다.비특이적 증폭이 발생하면 정량화가 부정확해집니다.따라서 프라이머가 디자인된 후에는 BLAST로 테스트를 거쳐야 하며, 염기서열 데이터베이스에서 산물의 특이성을 비교한다.
다음으로 인간 GAS6(Growth arrest specific 6) 유전자를 예로 들어 qPCR 프라이머를 디자인합니다.
01 쿼리 유전자
호모 GAS6NCBI를 통해 .여기에서 유전자 이름과 종을 비교하여 일치하는지 확인하는 데 주의를 기울여야 합니다.
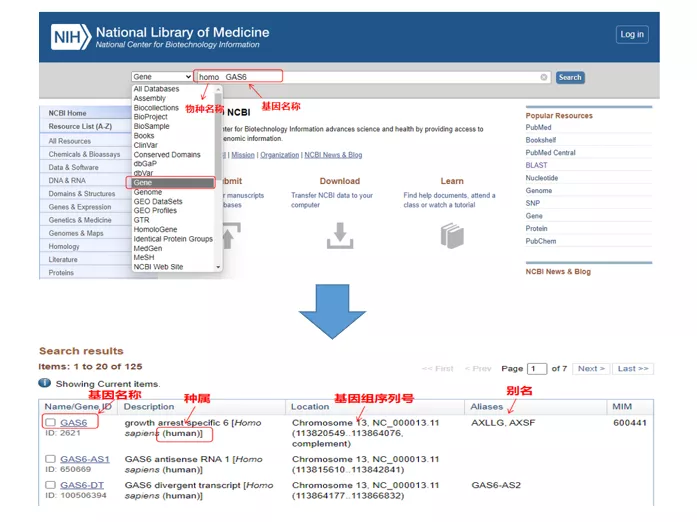 02 유전자 염기서열 찾기
02 유전자 염기서열 찾기
(1) target sequence가 genomic DNA인 경우, 유전자의 genomic DNA sequence인 첫 번째 것을 선택합니다.
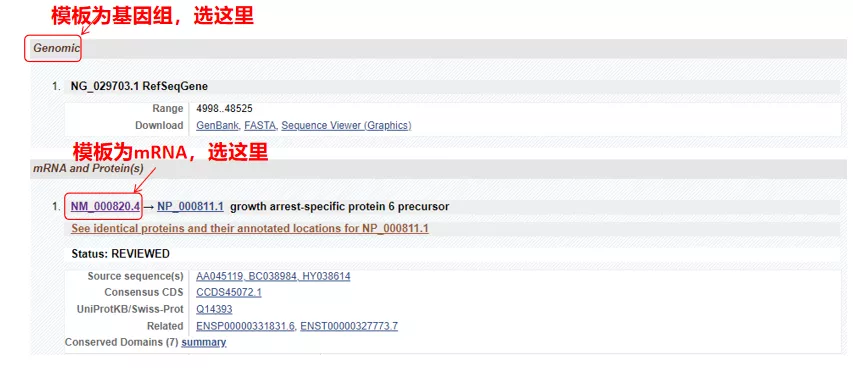 (2) target sequence가 mRNA인 경우 두 번째 것을 선택합니다.입력 후 아래 표에서 “CDS”를 클릭합니다.갈색 배경 서열은 유전자의 코딩 서열이다.
(2) target sequence가 mRNA인 경우 두 번째 것을 선택합니다.입력 후 아래 표에서 “CDS”를 클릭합니다.갈색 배경 서열은 유전자의 코딩 서열이다.
 03 디자인 프라이머
03 디자인 프라이머
Primer-BLAST 인터페이스 입력
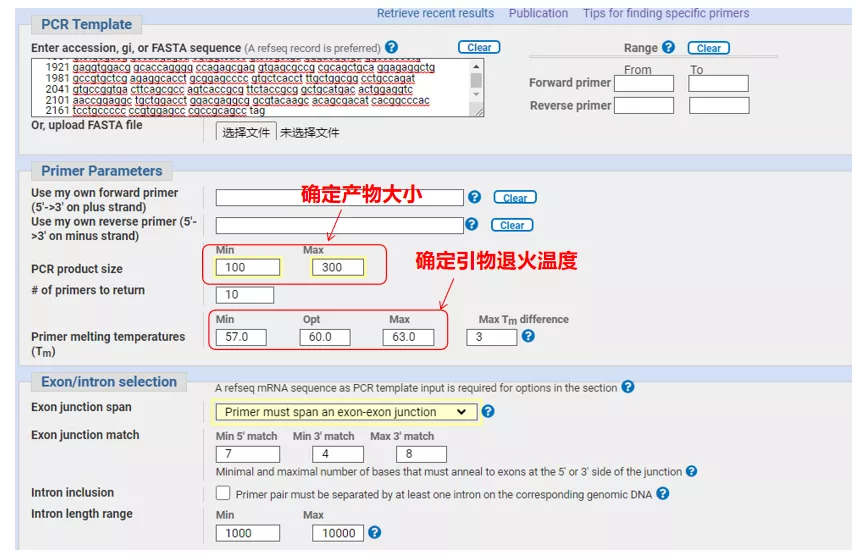
 왼쪽 상단에 유전자 시퀀스 번호 또는 Fasta 형식의 시퀀스를 입력하고 관련 매개변수를 입력합니다.
왼쪽 상단에 유전자 시퀀스 번호 또는 Fasta 형식의 시퀀스를 입력하고 관련 매개변수를 입력합니다.
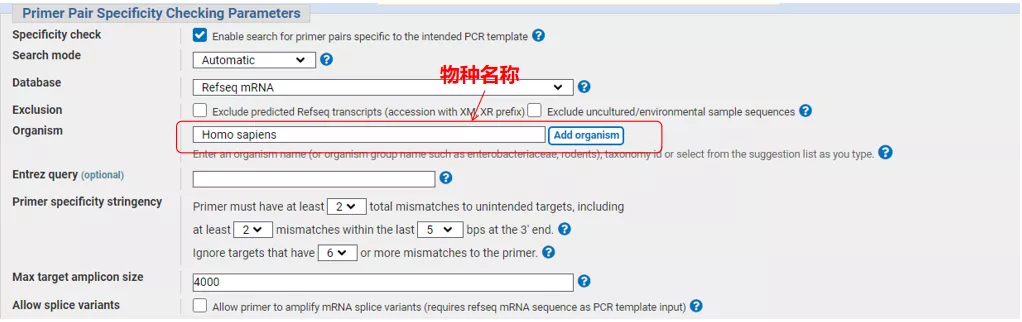
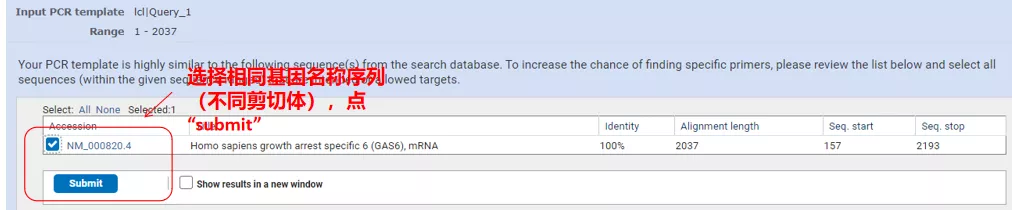
"프라이머 가져오기"를 클릭하면 NCBI가 팝업되어 이러한 매개변수 선택이 다른 스플라이싱 변형으로 증폭될 것임을 알려줍니다.다양한 스플라이싱 변형을 확인하고 제출하여 적절한 프라이머 쌍을 얻을 수 있습니다(아래 그림 참조).이 프로세스를 실행하는 데 수십 초가 걸릴 수 있습니다.
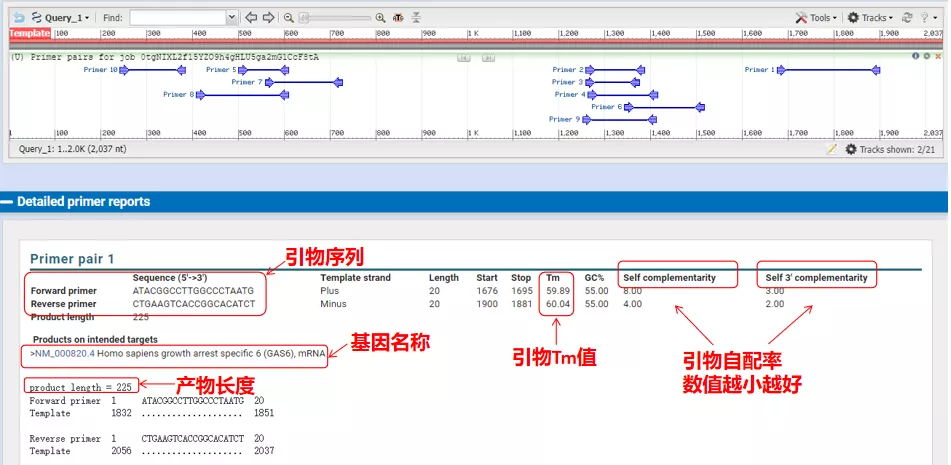 이러한 프라이머 쌍의 어닐링 온도는 모두 약 60°C입니다.실험의 목적에 따라 길이가 적당하고 특이성이 좋고 실험을 위한 프라이머의 자기 보완이 적은 프라이머를 선택하면 성공률이 상당히 높습니다!
이러한 프라이머 쌍의 어닐링 온도는 모두 약 60°C입니다.실험의 목적에 따라 길이가 적당하고 특이성이 좋고 실험을 위한 프라이머의 자기 보완이 적은 프라이머를 선택하면 성공률이 상당히 높습니다!
04프라이머 특이성 검증
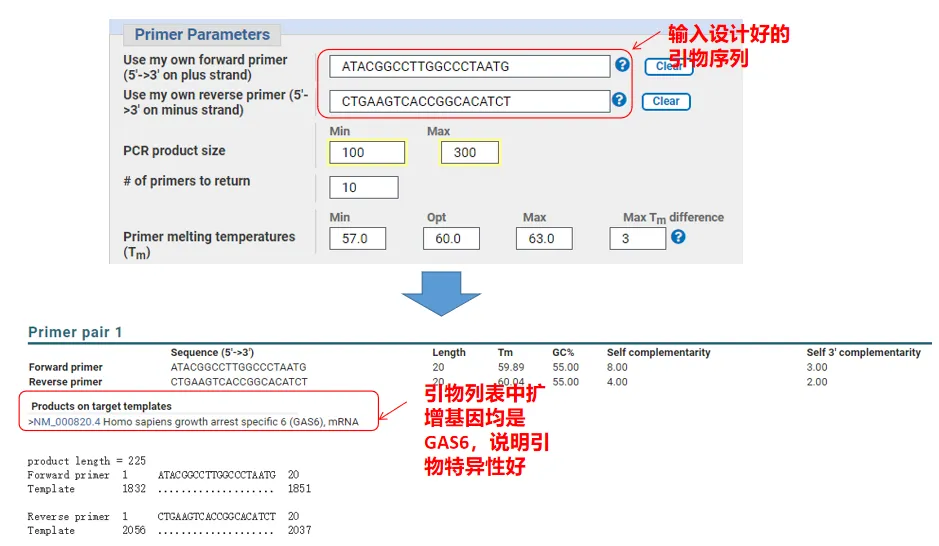
실제로 Primer-Blast는 프라이머 디자인 외에도 우리가 직접 디자인한 프라이머를 평가할 수도 있습니다.프라이머 디자인 페이지로 돌아가서 우리가 디자인한 업스트림 및 다운스트림 프라이머를 입력하면 다른 매개변수는 조정되지 않습니다.제출 후 프라이머 쌍이 다른 유전자에도 존재하는지 확인할 수 있습니다.이들 모두가 증폭하려는 유전자에 표시되면 이 프라이머 쌍의 특이성이 크다는 것을 나타냅니다!(예를 들어 이것은 프라이머 쿼리의 유일한 결과입니다!)
05 Primer 품질판단
"기준에 맞는 증폭 효율", "증폭된 제품 특성", "신뢰할 수 있는 실험 결과"를 겸비한 "완벽한" 프라이머는 어떤 프라이머일까요?
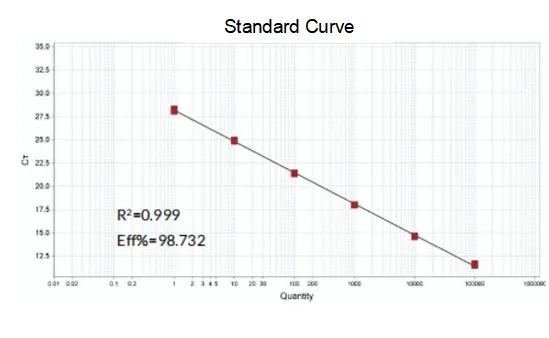 증폭 효율
증폭 효율
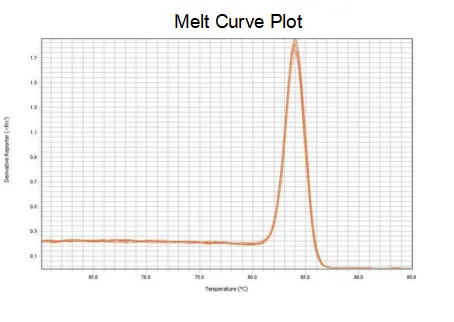 녹는 곡선
녹는 곡선
프라이머의 증폭 효율은 90%-110%에 이르며 이는 증폭 효율이 양호함을 의미하고 용융 곡선은 단일 피크를 가지며 일반적으로 Tm>80°C는 증폭 특이성이 양호함을 의미합니다.
관련 상품:
Real Time PCR Easy–SYBR GREEN I
실시간 PCR Easy-Taqman
게시 시간: 2023년 2월 10일








