분자진단기술은 분자생물학적 방법을 이용하여 인체의 유전물질과 각종 병원체의 발현과 구조를 파악하여 질병을 예측하고 진단하는 목적을 달성하는 기술입니다.
최근 몇 년 동안 분자 진단 기술의 업그레이드 및 반복으로 분자 진단의 임상 적용은 점점 더 광범위하고 심화되었으며 분자 진단 시장은 급속한 발전시기에 접어 들었습니다.
저자는 시중에서 흔히 볼 수 있는 분자진단 기술을 정리하여 1부 PCR 기술 소개, 2부 핵산 등온 증폭 기술 소개, 2부 시퀀싱 기술 소개 등 3부로 나누어 설명한다.
01
파트 I: PCR 기술
PCR 기술
PCR(Polymerase Chain Reaction)은 30년 이상의 역사를 가진 in vitro DNA 증폭 기술 중 하나입니다.
PCR 기술은 1983년 미국 Cetus의 Kary Mullis에 의해 개척되었습니다.멀리스는 1985년 PCR 특허를 신청했고 같은 해 사이언스에 관한 최초의 PCR 학술 논문을 발표했다.멀리스는 1993년에 노벨 화학상을 수상했습니다.
PCR의 기본 원리
PCR은 표적 DNA 조각을 백만 배 이상 증폭할 수 있습니다.원리는 DNA 중합효소의 촉매 작용 하에 부모 가닥 DNA가 주형으로 사용되고 특정 프라이머가 확장의 시작점으로 사용된다는 것입니다.변성, 어닐링 및 확장과 같은 단계를 통해 시험관 내에서 복제됩니다.모 가닥 주형 DNA에 상보적인 딸 가닥 DNA의 과정.
표준 PCR 프로세스는 세 단계로 나뉩니다.
1. 변성: DNA 이중 가닥을 분리하기 위해 고온을 사용합니다.DNA 이중 가닥 사이의 수소 결합은 고온(93-98°C)에서 끊어집니다.
2. 어닐링(Annealing): 이중 가닥 DNA를 분리한 후 프라이머가 단일 가닥 DNA에 결합할 수 있도록 온도를 낮춥니다.
3. 연장: DNA 중합효소는 온도가 낮아지면 결합된 프라이머로부터 DNA 가닥을 따라 상보적인 가닥을 합성하기 시작합니다.연장이 완료되면 주기가 완료되고 DNA 조각의 수가 두 배가 됩니다.
이 세 단계를 25-35번 반복하면 DNA 조각의 수가 기하급수적으로 증가합니다.
PCR의 독창성은 서로 다른 표적 유전자에 대해 서로 다른 프라이머를 설계할 수 있으므로 표적 유전자 단편을 단시간에 증폭할 수 있다는 것입니다.
지금까지 PCR은 일반 PCR, 형광 정량 PCR 및 디지털 PCR의 세 가지 범주로 나눌 수 있습니다.
일반 PCR의 1세대
일반 PCR 증폭장비를 이용하여 target gene을 증폭한 후 agarose gel 전기영동을 이용하여 산물을 검출하면 정성분석만 가능합니다.
1세대 PCR의 주요 단점:
-비특이적 증폭 및 위양성 결과가 발생하기 쉽습니다.
-탐지 시간이 오래 걸리고 조작이 번거롭다.
- 정성적인 테스트만 가능합니다.
2세대 형광 정량 PCR
qPCR로도 알려진 형광 정량적 PCR(Real-Time PCR)은 반응계의 진행 상황을 알 수 있는 형광 프로브를 추가하여 형광 신호의 축적을 통해 증폭된 산물의 축적을 모니터링하고, 형광 곡선을 통해 결과를 판단하는 데 사용되며, Cq 값과 표준 곡선의 도움을 받아 정량화할 수 있습니다.
qPCR 기술은 밀폐된 시스템에서 진행되기 때문에 오염 가능성이 적고 정량적 검출을 위해 형광 신호를 모니터링할 수 있어 임상에서 가장 널리 사용되며 PCR에서 지배적인 기술이 됐다.
실시간 형광 정량 PCR에 사용되는 형광 물질은 TaqMan 형광 프로브, 분자 비콘 및 형광 염료로 나눌 수 있습니다.
1) TaqMan 형광 프로브:
PCR 증폭 동안 한 쌍의 프라이머를 추가하면서 특정 형광 프로브를 추가합니다.프로브는 올리고뉴클레오타이드이고, 2개의 말단은 각각 리포터 형광 그룹 및 소광제 형광 그룹으로 표지된다.
프로브가 손상되지 않으면 리포터 그룹에서 방출된 형광 신호가 소광 그룹에 의해 흡수됩니다.PCR 증폭 시 Taq 효소의 5'-3' 엑소뉴클레아제 활성이 프로브를 절단 및 분해하여 리포터 형광 그룹과 소광기를 만듭니다. 형광 그룹이 분리되어 형광 모니터링 시스템이 형광 신호를 받을 수 있습니다. 즉, DNA 가닥이 증폭될 때마다 형광 분자가 형성되고 형광 신호의 축적은 PCR 산물의 형성과 완전히 동기화됩니다.
2) SYBR 형광 염료:
PCR 반응 시스템에서 과잉의 SYBR 형광 염료가 첨가됩니다.SYBR 형광 염료가 DNA 이중 가닥에 비특이적으로 결합된 후 형광 신호를 방출합니다.체인에 통합되지 않은 SYBR 염료 분자는 형광 신호를 방출하지 않으므로 형광 신호를 보장합니다. PCR 산물의 증가는 PCR 산물의 증가와 완전히 동기화됩니다.SYBR은 이중 가닥 DNA에만 결합하므로 용융 곡선을 사용하여 PCR 반응이 특이적인지 여부를 확인할 수 있습니다.
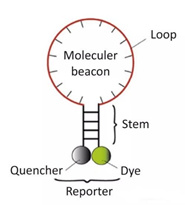
3) 분자 표지
5번과 3번 말단에 약 8개의 염기로 이루어진 헤어핀 구조를 형성하는 스템-루프 이중 표지 올리고뉴클레오티드 프로브입니다.양 말단의 핵산 서열은 상보적으로 쌍을 이루어 형광기와 소광기가 팽팽하게 된다.닫기, 형광을 생성하지 않습니다.
PCR 산물이 생성된 후 어닐링(annealing) 과정에서 분자 비콘의 중간 부분이 특정 DNA 서열과 쌍을 이루고, 형광 유전자와 소광 유전자가 분리되어 형광을 발생시킨다.
2세대 PCR의 주요 단점:
감도가 여전히 부족하고 복사량이 적은 표본의 감지가 정확하지 않습니다.
배경 값의 영향이 있으며 결과는 간섭에 취약합니다.
3세대 디지털 PCR
Digital PCR(DigitalPCR, dPCR, Dig-PCR)은 end-point detection을 통해 target sequence의 copy number를 계산하며 내부 control과 standard curve를 사용하지 않고 정확한 절대 정량 검출을 할 수 있습니다.
Digital PCR은 endpoint detection을 이용하고 Ct 값(cycle threshold)에 의존하지 않기 때문에 디지털 PCR 반응은 증폭 효율의 영향을 덜 받고 PCR 반응 저해제에 대한 내성이 향상되어 정확도와 재현성이 높습니다.
고감도, 고정확도 특성으로 인해 PCR 반응 억제제의 간섭을 쉽게 받지 않으며 표준 제품 없이도 진정한 절대 정량화를 달성할 수 있어 연구 및 응용 핫스팟이 되었습니다.
반응 장치의 다양한 형태에 따라 미세 유체, 칩 및 액적 시스템의 세 가지 유형으로 나눌 수 있습니다.
게시 시간: 2021년 7월 8일