PCR, 다수의 PCR, 제자리 PCR, 역방향 PCR, RT-PCR, qPCR(1)–PCR
다양한 PCR의 개념과 단계, 세부사항을 정리해드립니다.
Ⅰ. PCR
중합효소 연쇄반응(Polymerase Chain Reaction, PCR)은 특정 DNA 단편을 확대하는 데 사용되는 분자생물학적 기술입니다.그것은 시험관 내에서 특별한 DNA 복제로 간주될 수 있습니다.DNA 중합효소(DNA Polymerase I)는 일찍이 1955년에 발견되었고, 실험적 가치와 실용성을 지닌 대장균의 Klenow Fragment는 1970년대 초 H. Klenow 박사에 의해 발견되었지만, 이 효소는 온도를 견디지 못하기 때문에 고온에서 변성될 수 있어 고온변성을 동반한 중합효소연쇄반응을 만나지 못한다.현재 사용하고 있는 효소(Taq polymerase라 함)는 1976년 온천세균인 Thermus aquaticus에서 분리한 것이다. 고온에 견딜 수 있고 이상적인 효소라는 것이 특징이지만 1980년대 이후 널리 쓰이고 있다.PCR의 원래 원시 프로토타입의 원래 개념은 1971년 KJell Kleppe 박사가 제안한 유전자 복구 및 복사와 유사합니다. 그는 최초의 단순 및 단기 유전자 복사(PCR의 처음 두 주기 반응과 유사)를 발표했습니다.오늘날 개발된 PCR은 1983년 Kary B. Mullis 박사에 의해 개발되었습니다. Mullis 박사는 그해에 PE 회사에 근무했기 때문에 PE는 PCR 업계에서 특별한 지위를 가지고 있습니다.Mullis 박사는 1985년에 Saiki 등과 관련 논문을 공식적으로 발표했습니다. 그 이후로 PCR의 사용은 하루에 수천 마일이고 관련 논문의 품질은 다른 많은 연구 방법을 불쾌하게 만든다고 할 수 있습니다.그 후 PCR 기술은 생물학 연구 및 임상 응용 분야에서 널리 사용되어 분자 생물학 연구의 가장 중요한 기술이 되었습니다.멀리스는 또한 1993년 노벨 화학상을 수상했습니다.
PCR원칙
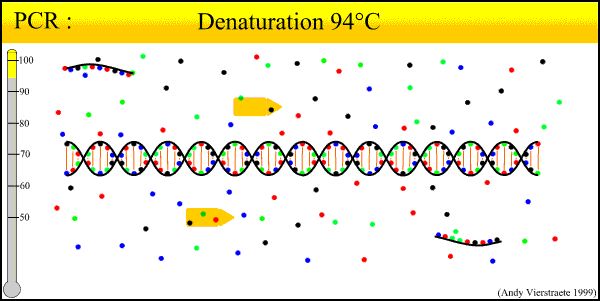
PCR 기술의 기본 원리는 DNA의 자연 복제 과정과 유사하며 그 특이성은 표적 서열의 양 말단에 상보적인 올리고뉴클레오타이드 프라이머에 달려 있습니다.PCR은 degeneration-annealing-extend의 세 가지 기본 반응 단계로 구성된다. ① template DNA의 변성: template DNA를 일정 시간 동안 약 93°C로 가열한 후 template DNA의 PCR 증폭으로 형성된 dual-chain DNA용 dual DNA solution을 남기고 이를 single chain으로 만들어 primer와 결합하여 다음 round reaction을 준비한다.② template DNA와 primer의 annealing(compound): template DNA를 가열하여 단일 사슬로 변성시킨 후 약 55°C까지 온도가 떨어집니다.프라이머와 주형 DNA 단일 사슬의 상보적 서열.③프라이머의 확장: DNA 템플릿-프라이머 결합은 dNTP를 반응 원료로 하는 TaqDNA 중합효소의 작용을 기반으로 합니다.복제의 원리를 유지하고, 주형 DNA 사슬을 보완하는 새로운 반 예약 사본 사슬을 합성하고, 퇴화-어닐링-신장 주기를 반복하는 세 가지 프로세스는 더 많은 "반 예약 사본 사슬"을 얻을 수 있으며, 이 새로운 사슬은 다시 사용 가능하여 다음 주기의 템플릿이 됩니다.루프를 완료하는 데 2-4분이 걸리며 표적 유전자는 2-3시간 내에 수백만 번 증폭될 수 있습니다.
기준PCR반응 시스템
| Taq DNA 중합효소 | 2.5μl |
| 마그네슘2+ | 1.5mmol/L |
| 10배 증폭 버퍼 | 10μl |
| 4개의 dNTP 혼합물 | 200μl |
| 템플릿 DNA | 0.1~2μg |
| 뇌관 | 10~100μl |
| 이중 또는 삼중 김이 나는 물을 추가하십시오 | 100μl |
PCR 반응의 5가지 요소
PCR 반응에 관여하는 물질은 주로 프라이머, 효소, dNTP, 주형, 완충액(Mg2+ 필요)의 5가지입니다.[PCR 절차]
표준 PCR 과정은 세 단계로 나뉩니다.
1. DNA 변성(90°C-96°C): 열 작용 하에서 이중 사슬 DNA 주형, 수소 결합이 끊어져 단일 사슬 DNA를 형성합니다.
2. Annealing (25℃ -65℃): 시스템 온도를 낮추고, primer는 DNA template와 결합하여 local dual-chain을 형성합니다.
3. Extension (70℃ -75℃): Taq 효소의 작용(약 72℃, 최고활성도)하에 dNTP를 원료로 사용하여 primer의 5′말단 → 3′말단에서 extension, 합성과 template가 서로 DNA chain을 보완합니다.
각 주기는 변성, 어닐링 및 확장되어 DNA 함량을 두 배로 늘립니다.현재는 짧은 증폭 영역으로 인해 Taq 효소 활성이 최적이 아니더라도 일부 PCR은 매우 짧은 시간에 복제될 수 있으므로 60°C-65°C에서 annealing과 extension을 동시에 수행할 수 있는 두 단계로 변경할 수 있습니다.리프팅 및 냉각 과정을 줄이고 응답 속도를 향상시키기 위해.
PCR 반응 기능
● 높은 특이성
PCR 반응의 특정 결정 요인은 다음과 같습니다. ① 프라이머와 주형 DNA의 특정 조합.②염기쌍의 원리.③TaqDNA 중합효소 합성 반응의 충성도.④표적 유전자의 특이성과 보존성.
프라이머와 템플릿의 올바른 조합이 핵심입니다.프라이머와 주형의 결합 및 프라이머 사슬의 연장은 알칼리 염기 매칭의 원리에 기초합니다.중합효소 합성 반응의 충성도와 Taq DNA 중합효소의 높은 온도 저항성은 반응에서 주형과 프라이머의 결합(화합물)을 더 높은 온도에서 수행할 수 있습니다.조합의 특이성이 크게 증가합니다.클립은 높은 정확도를 유지할 수 있습니다.보존성과 보존성이 높은 표적 유전자 부위를 선별하여 특이도를 높인다.
● 고감도
PCR 산물의 생산량은 인덱스에 의해 증가되며, 이는 Picker(PG=10-12)의 시작 템플릿을 확장하여 마이크로컨트롤러 수준을 마이크로그램(μg=-6) 수준으로 높일 수 있습니다.표적 세포는 100만 개의 세포에서 검출할 수 있습니다.바이러스 검출에서 PCR 민감도는 3 RFU(빈 반점 형성 단위)에 도달할 수 있습니다.박테리아 과학의 최소 검출률은 3개 박테리아입니다.
● 간단하고 빠름
PCR 반사는 반응액을 한번에 첨가하는 고온 Taq DNA polymerase를 사용하는데, 즉 DNA 증폭액과 water bath pot에 대한 degeneration-anneal-extension 반응이다.일반적으로 증폭 반응은 2~4시간이면 완료된다.증강 제품은 일반적으로 전기 검으로 분석되며 동위 원소를 사용할 필요가 없으며 방사능 오염이 없으며 홍보가 용이합니다.
● 검체의 순도가 낮다
바이러스나 세균과 배양세포를 분리할 필요가 없습니다.DNA 원유 제품 및 RNA는 증폭기로 사용할 수 있습니다.DNA 증폭 검출은 혈액, 체액, 기침 세척액, 모발, 세포, 생체 조직 등의 임상 검체를 이용하여 직접 사용할 수 있습니다.
PCR일반적인 문제
● 위음성, 증폭 대역 없음
PCR 반응의 주요 단계는 다음과 같습니다. ① 주형 핵산의 준비, ② 프라이머의 품질 및 특이성, ③ 효소의 품질 ④ PCR 주기 조건.위의 링크에 대한 이유 찾기도 분석 및 연구해야 합니다.
템플릿: ① 템플릿에 잡다한 단백질이 포함되어 있습니다. ② 템플릿에 Taq 효소 억제제가 포함되어 있습니다. ③ 템플릿의 단백질, 특히 염색체의 그룹 단백질이 제거되지 않습니다.⑤ Deminer 핵산 변성은 철저하지 않다.효소와 프라이머의 품질이 좋으면 증폭밴드가 없기 때문에 검체의 소화처리일 가능성이 높다.주형 핵산 추출 과정에 이상이 있기 때문에 효과적이고 안정적인 소화 용액을 준비하기 위해서는 그 과정이 임의로 바뀌지 않고 고정되어야 합니다.
효소 불활성화: 새로운 효소 또는 이전 효소와 새로운 효소를 함께 사용하여 효소 활성이 손실되었는지 또는 불충분한지 분석하여 위음성으로 이어져야 합니다.Taq 효소 또는 에티디움 브로마이드가 때때로 잊혀진다는 점에 유의해야 합니다.
Primer: 프라이머의 품질, 프라이머의 농도, 두 프라이머의 농도가 대칭인지 여부.이는 PCR 실패 또는 증가 대역이 이상적이지 않고 확산되기 쉬운 일반적인 이유입니다.일부 배치 번호의 프라이머 품질에 문제가 있습니다.두 개의 프라이머는 고농도와 저농도를 가지므로 저효율 비대칭 증폭을 유발합니다.대책은 다음과 같다. ① 좋은 프라이머를 선택하여 유닛을 합성한다.② Primer의 농도는 OD 값에 따라 달라질 뿐만 아니라 한천당 겔 전기영동을 하기 위한 Primer의 원래 액체에도 주의를 기울입니다.프라이머 스트립 영역이 있어야 하며 두 프라이머의 밝기가 일반적으로 일정해야 합니다.이때 Belt, PCR이 실패할 수 있으며 이는 Primer Synthesis Unit으로 해결해야 합니다.프라이머가 높으면 명도가 낮아 희석시 농도의 균형을 맞춰야 합니다.③ Primer는 냉장고의 다중동결이나 장기냉동 부품의 열화 및 열화를 방지하기 위해 고농도로 급여하여 보관하여야 한다.④ Primer의 길이가 불충분하고 Primer 사이에 Di Cluster가 형성되는 등 Primer의 설계가 불합리하다.
Mg2+ 농도: Mg2+ 이온 농도는 PCR 증폭 효율에 큰 영향을 미칩니다.과도한 농도는 PCR 증폭의 이성을 감소시킬 수 있습니다.농도가 너무 낮으면 PCR 증폭 출력이 확장 밴드 없이도 PCR 증폭 실패를 만듭니다.
반응 부피의 변화: PCR 증폭에 사용되는 부피는 20ul, 30ul, 50ul 또는 100uL이며, PCR 증폭을 위한 응용의 큰 부피는 과학 연구 및 임상 시험의 다른 목적에 따라 설정됩니다.20ul 정도 소량 제작 후 사이즈 제작시 끈 상태로 만들어주셔야 실패합니다.
물리적 이유: 형질전환은 PCR 증폭에 매우 중요합니다.변성 온도가 낮으면 변성 시간이 짧고 위음성이 발생할 가능성이 높습니다.어닐링 온도가 너무 낮으면 비특이적 증폭이 발생하고 특정 증폭 효율이 감소할 수 있습니다.primer와 template의 조합에 큰 영향을 주어 PCR 증폭 효율을 떨어뜨립니다.경우에 따라 표준 온도계를 사용하여 확장 또는 수용성 조리기의 가변성, 어닐링 및 확장된 온도를 감지해야 하는데 이는 PCR 실패의 원인 중 하나입니다.
Target sequence variants: target sequence가 발생하거나, 돌연변이나 결손이 발생하거나, prototype과 template의 조합이 결합되거나, target sequence가 부족하여 primer와 template이 상보적인 sequence를 잃게 되어 PCR 증폭이 잘 되지 않습니다.
● 거짓양성
PCR 증폭 대역은 표적 서열 대역과 일치하는 것으로 나타나며 때로는 그 대역이 더 깔끔하고 높게 나타나기도 합니다.
프라이머 디자인이 적절하지 않음: 선택한 증폭 서열과 비목적 증폭 서열이 상동이므로 PCR 증폭 시 증폭된 PCR 산물은 비목적 서열입니다.표적 염기서열이 너무 짧거나 프라이머가 너무 짧아 위양성이 되기 쉽습니다.재설계가 필요합니다.
표적 서열 또는 증폭 산물의 교차 오염: 이러한 오염에는 두 가지 이유가 있습니다. 첫째, 전체 게놈 또는 큰 세그먼트의 교차 오염으로 인해 위양성(false positive)이 발생합니다.이러한 종류의 오탐은 다음과 같은 방법으로 해결할 수 있습니다. 대상 시퀀스가 샘플 건으로 흡입되거나 원심 튜브에서 튀는 것을 방지하기 위해 작동 중에 조심스럽고 부드럽습니다.고온을 견딜 수 없는 효소와 물질을 제외하고 모든 시약이나 장비는 고압으로 소독해야 합니다.원심 파이프와 샘플은 한 번에 사용해야 합니다.필요한 경우 검체를 추가하기 전에 반응관과 시약을 자외선에 노출시켜 기존 핵산을 파괴합니다.둘째, 대기 오염의 작은 파편.이 작은 단편은 표적 서열보다 짧지만 일정한 상동성을 가지고 있습니다.그것은 서로 접합될 수 있습니다.프라이머를 보완한 후 PCR 산물이 확장될 수 있으며 이로 인해 위양성 생성이 발생할 수 있습니다.Nest PCR 방법을 줄이거나 제거하는 데 사용할 수 있습니다.
● 비특이 증폭대역이 나타난다.
PCR 증폭 후에 나타나는 밴드는 예상되는 크기와 일치하지 않거나 크거나 작거나 동시에 또는 동시에 특정 증폭 밴드와 비특이 증폭 밴드입니다.비특이적 밴드의 출현은 첫째, 프라이머가 표적 서열에 불완전하게 상보적이거나, 프라이머가 중합되어 디클러스터를 형성하는 것입니다.두 번째는 MG2+이온의 농도가 너무 높고 어닐링 온도가 너무 낮으며 PCR 사이클 수가 관련되어 있다는 것입니다.둘째, 효소의 질과 양입니다.종종 일부 소스의 효소는 비특수 밴드가 발생하기 쉽고 다른 소스의 효소는 발생하지 않습니다.때로는 효소의 비특이적 증폭도 발생합니다.대책은 다음과 같습니다. 필요한 경우 어트랙션을 재설계합니다.효소의 양을 줄이거나 다른 소스의 효소로 교체하십시오.기본 양을 줄이고 템플릿 양을 적절하게 늘리고 주기 수를 줄이십시오.어닐링 온도를 적절하게 높이거나 두 온도 포인트 방법(93°C 변성, 어닐링 및 약 65°C에서 연장)을 사용하십시오.
● 벗겨지기 쉬운 토우 또는 스미어 테이프가 나타납니다.
PCR 증폭은 때때로 적용되거나 벗겨지거나 카펫 같은 벨트로 나타납니다.그로 인해 효소의 양이 너무 많거나 효소의 품질이 좋지 않아 dNTP 농도가 너무 높고, Mg2+ 농도가 너무 높고, 어닐링 온도가 너무 낮고, 사이클 수가 너무 많습니다.대책은 ①효소의 양을 줄이거나, 다른 소스의 효소로 바꾼다.②dNTP의 농도를 줄인다. ③Mg2+ 농도를 적당히 줄인다.④템플릿 수를 늘리고 주기 수를 줄입니다.
관련 상품
◮ 더 높은 충실도: 일반 Taq 효소의 6배;
◮ 더 빠른 증폭 속도
◮ 더 많은 템플릿 적응성
◮ 증폭 효율 향상
◮ 환경 내성이 강함: 일주일 동안 37°C에 두어 90% 이상의 활성을 유지합니다.
◮ 5'→3' DNA polymerase 활성과 5'→3' exonuclease 활성을 가지고 있으며 3'→5' exonuclease 활성은 없다.
고유한 반응 시스템과 고효율 Taq DNA Polymerase는 PCR 반응의 증폭 효율, 특이성 및 민감도를 높입니다.
RT-qPCR Easyᵀᴹ (원스텝)-SYBR Green I
◮ One-step kit로 동일한 튜브에서 역전사 및 qPCR 2가지 반응 수행, template RNA, 특정 PCR primer 및 RNase-Free ddH만 추가하면 됨2O.
◮ 바이러스 RNA 또는 미량 RNA를 신속하고 효율적으로 정량 분석할 수 있는 키트입니다.
◮ 이 키트는 Foregene 고유의 역전사 시약과 Foregene HotStar Taq DNA Polymerase가 고유한 반응 시스템과 결합되어 반응의 증폭 효율과 특이성을 효과적으로 향상시키는 키트입니다.
◮ 최적화된 반응 시스템은 반응이 더 높은 검출 감도, 더 강한 열 안정성 및 더 나은 내성을 갖도록 합니다.
◮ RT-qPCR 간편TM(One Step)-SYBR Green I 키트에는 ROX 내부 참조 염료가 포함되어 있어 웰 사이의 신호 배경 및 신호 오류를 제거하는 데 사용할 수 있어 고객이 여러 모델의 정량 PCR 장비에서 사용하기 편리합니다.
RT 이지TMII (마스터 프리믹스 첫 가닥 cDNA 합성실시간 PCR)
-gDNA를 효율적으로 제거하는 능력으로 template내의 gDNA를 2분 이내에 제거할 수 있습니다.
-효율적인 역전사 시스템으로 첫 번째 가닥 cDNA의 합성을 완료하는 데 15분밖에 걸리지 않습니다.
-복잡한 템플릿: GC 함량이 높고 복잡한 2차 구조가 있는 템플릿도 높은 효율로 역전할 수 있습니다.
- 고감도 역전사 시스템, pg 수준의 템플릿으로도 고품질의 cDNA를 얻을 수 있습니다.
-역전사 시스템은 열적 안정성이 높고, 최적의 반응 온도는 42℃이며, 50℃에서도 역전사 성능이 여전히 양호합니다.
게시 시간: 2023년 3월 18일