개요
형질전환 식물의 신속한 식별
문자/통유청
실험작전/한잉
에디터/원유준
단어/1600+
권장 읽기 시간/8-10분
형질전환 식물의 신속한 식별
연구실의 신입생으로서 전환율이 낮은 식물 다발에서 양성 식물을 걸러내는 것은 좋은 일이 아닙니다.첫째, 많은 수의 샘플에서 하나씩 DNA를 추출해야 하며, 그런 다음 외래 유전자를 PCR로 검출합니다.그러나 결과는 때때로 몇 개의 항목이 있는 공백 및 밴드인 경우가 많지만 누락된 감지 또는 잘못된 감지가 있는지 여부를 판별하는 것은 불가능합니다..이러한 실험 과정과 결과를 마주하는 것이 너무 속수무책일까요?걱정마세요 형님이 쉽고 정확하게 형질전환 양성 식물을 선별하는 방법을 알려드립니다.
1 단계: 디자인 감지 프라이머
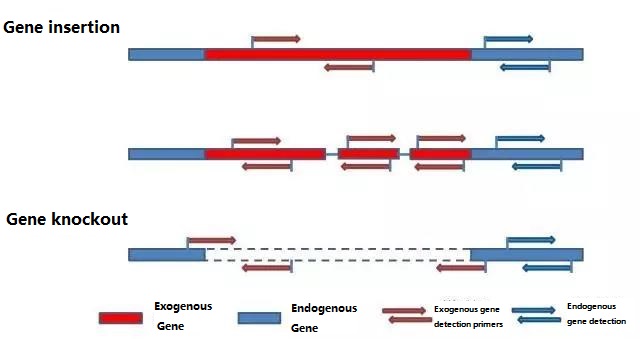
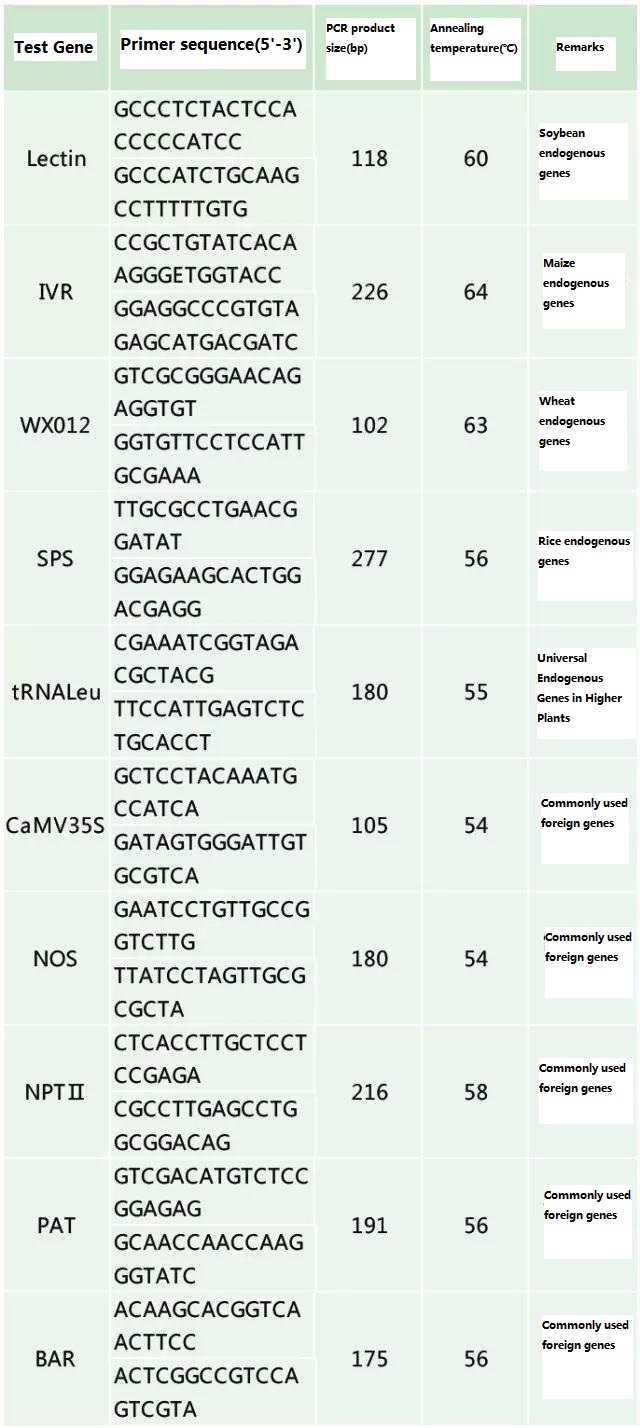
검사 대상 시료에 따라 검출하고자 하는 내인성 유전자와 외인성 유전자를 결정하고, 프라이머 설계를 위한 유전자 중 대표적인 100-500bp 염기서열을 선정합니다.좋은 프라이머는 검출 결과의 정확성을 보장하고 검출 시간을 단축할 수 있습니다(일반적으로 사용되는 검출 프라이머는 부록 참조).
메모:
새로 설계된 프라이머는 반응 조건을 최적화하고 대규모 검출을 수행하기 전에 검출의 정확도, 정밀성 및 검출 한계를 검증해야 합니다.
2 단계:실험 프로토콜 개발

양성 대조군: target fragment가 포함된 정제된 DNA를 주형으로 사용하여 PCR 반응 시스템 및 조건이 정상인지 확인합니다.
음성/블랭크 컨트롤: DNA 템플릿 또는 ddH 사용2PCR 시스템에 오염원이 있는지 여부를 검출하기 위한 주형으로 target fragment가 포함되지 않은 O.
Internal reference control: 테스트할 샘플의 내인성 유전자의 프라이머/프로브 조합을 사용하여 주형이 PCR로 검출될 수 있는지 여부를 평가합니다.
메모:
실험 결과의 유효성을 평가하기 위해 각 테스트에 대해 양성, 음성/공백 컨트롤 및 내부 컨트롤 컨트롤을 설정해야 합니다.
3단계: 실험 준비

사용하기 전에 용액이 고르게 섞였는지 관찰하십시오.침전물이 발견되면 사용하기 전에 지침에 따라 용해 및 혼합해야 합니다.2×PCR mix는 균일하지 않은 이온 분포를 피하기 위해 사용하기 전에 마이크로피펫으로 반복적으로 피펫팅하고 혼합해야 합니다.
메모:
지시사항을 꺼내 잘 읽고 지시사항에 따라 실험 전에 철저히 준비하십시오.
4단계: PCR 반응 시스템 준비
실험 프로토콜에 따라 프라이머 H를 혼합합니다.2O, 2×PCR mix, 원심분리하여 각각의 reaction tube에 분주한다.
메모:
대규모 또는 장기간의 테스트를 위해서는 PCR 산물에 의한 에어로졸 오염을 효과적으로 방지할 수 있는 UNG 효소가 포함된 PCR 반응 시스템을 사용하는 것이 좋습니다.
5단계: 반응 템플릿 추가

Direct PCR 기술을 이용하여 번거로운 핵산 정제 과정이 필요 없습니다.10분 이내에 샘플 템플릿을 준비하고 해당 PCR 반응 시스템에 추가할 수 있습니다.
메모:
Lysis 방법은 더 나은 검출 효과를 가지며 얻은 제품은 다중 검출 반응에 사용할 수 있습니다.
5.1: 잎의 직접 PCR
설명서에 있는 그림의 크기에 맞게 잎 조직을 직경 2~3mm로 잘라 PCR 반응기에 넣어줍니다.
참고: 잎 조각이 PCR 반응 용액에 완전히 잠겨 있는지 확인하고 과도한 잎 조직을 추가하지 마십시오.
5.2: 잎 용해 방법
잎 조직을 직경 5~7mm로 잘라 원심분리기 튜브에 넣는다.성숙한 잎을 선택하는 경우 잎의 주맥의 조직을 사용하지 마십시오.피펫 50ul Buffer P1 용해물을 원심분리 튜브에 넣어 용해물이 잎 조직을 완전히 담글 수 있도록 하고 열 순환기 또는 금속 수조에 넣고 95°C에서 5-10분 동안 용해합니다.


50ul Buffer P2 중화액을 넣고 잘 섞는다.생성된 용해물은 주형으로 사용되어 PCR 반응 시스템에 추가될 수 있습니다.
참고: 템플릿의 양은 PCR 시스템의 5-10% 사이여야 하며 20%를 초과하지 않아야 합니다(예: 20μl PCR 시스템에서 1-2μl의 용해 버퍼 추가, 4μl 이하).
6단계: PCR 반응

PCR reaction tube를 원심분리한 후 PCR 기기에 넣어 증폭한다.
메모:
반응은 증폭을 위해 정제되지 않은 템플릿을 사용하므로 증폭 사이클의 수는 정제된 DNA 템플릿을 사용할 때보다 5-10 사이클 더 많습니다.
7단계: 전기영동 검출 및 결과 분석

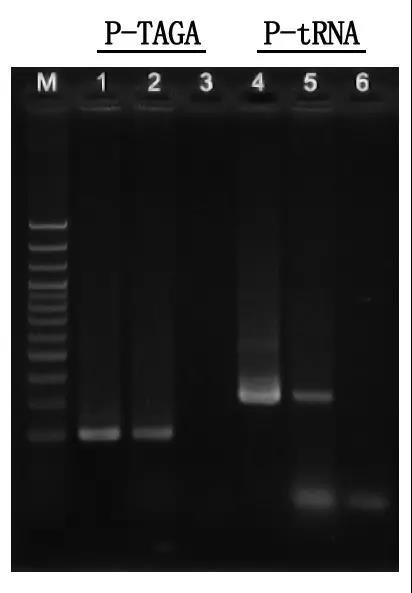
M:100bp DNA 사다리
1\4: 정제된 DNA 방법
2\5: 직접 PCR 방법
3\6: 빈 컨트롤
품질 관리:
실험에서 설정한 다양한 컨트롤의 테스트 결과는 다음 조건을 충족해야 합니다.그렇지 않으면 문제의 원인을 분석하고 문제가 제거된 후 테스트를 다시 수행해야 합니다.
표 1. 다양한 대조군의 정상 검사 결과

*플라스미드를 양성 대조군으로 사용할 경우 내인성 유전자 검사 결과가 음성일 수 있음
결과 판정:
가. 검체의 내인성 유전자 검사 결과가 음성인 것은 검체에서 일반적인 PCR 검출에 적합한 DNA를 추출할 수 없거나 추출된 DNA에 PCR 반응 억제제가 포함되어 있어 DNA를 다시 추출해야 함을 나타냅니다.
나. 검체의 내인성 유전자 검사 결과 양성, 외인성 유전자 검사 결과 음성으로 일반 PCR 검출에 적합한 DNA가 검체에서 추출되었음을 의미하며, 검체에서 XXX 유전자가 검출되지 않는 것으로 판단할 수 있다.
C. 검체의 내인성 유전자 검사 결과가 양성이고 외인성 유전자 검사 결과가 양성으로 이는 일반 PCR 검출에 적합한 DNA가 검체에서 추출되었으며 검체 DNA에 XXX 유전자가 포함되어 있음을 나타냅니다.확인 실험을 추가로 수행할 수 있습니다.
8단계: 검출 프라이머 설계

실험 후 환경 오염을 방지하기 위해 2% 차아염소산나트륨 용액과 70% 에탄올 용액을 사용하여 실험 영역을 닦습니다.
부록
표 2. 유전자 변형 식물의 일반적인 PCR 검출을 위해 일반적으로 사용되는 프라이머
참조 문서:
SN/T 1202-2010, 식품의 유전자 변형 식물 성분에 대한 정성적 PCR 검출 방법.
농업부 공고 1485-5-2010, 유전자 변형 식물 및 그 제품의 성분 테스트 - 쌀 M12 및 그 파생물.
게시 시간: 2021년 6월 9일








