면역글로불린(Ig)이라고도 하는 항체는 항원에 특이적으로 결합하는 당단백질입니다.
기존의 항체 제제는 동물을 면역화하고 항혈청을 수집하여 생산됩니다.따라서 항혈청은 일반적으로 다른 관련 없는 항원 및 혈청의 다른 단백질 성분에 대한 항체를 포함합니다.일반적인 항원 분자는 대부분 여러 개의 서로 다른 에피토프를 포함하므로 기존의 항체도 여러 개의 서로 다른 에피토프에 대한 항체의 혼합물입니다.동일한 에피토프에 대한 기존의 혈청 항체조차도 여전히 다른 B 세포 클론에 의해 생성된 이종 항체로 구성되어 있습니다.따라서 기존의 혈청항체를 다클론항체, 줄여서 다클론항체라고도 한다.
단클론 항체(monoclonal antibody)는 단일 B 세포 클론에 의해 생성되는 매우 균일한 항체이며 특정 에피토프에 대해서만 지시됩니다.일반적으로 하이브리도마 기술로 제조됩니다. 하이브리도마 항체 기술은 특정 항체를 분비하는 능력이 있는 B 세포와 무한한 성장 능력을 가진 골수종 세포를 B 세포 하이브리도마로 결합하는 세포 융합 기술을 기반으로 합니다.이 하이브리도마 세포는 친세포의 특징을 가지고 있습니다.그것은 골수종 세포처럼 시험관 내에서 무기한 불멸로 증식할 수 있으며 비장 림프구와 같은 특정 항체를 합성하고 분비할 수 있습니다.클로닝을 통해 단일 하이브리도마 세포, 즉 하이브리도마 세포주로부터 유래된 단일클론 세포주를 얻을 수 있다.그것이 생성하는 항체는 동일한 항원 결정자, 즉 단일 클론 항체에 대한 고도로 동질적인 항체입니다.
항체는 하나 이상의 Y자형 단량체(즉, 단클론 항체 또는 다클론 항체)로 존재합니다.각각의 Y자형 단량체는 2개의 동일한 중쇄와 2개의 동일한 경쇄를 포함하여 4개의 폴리펩티드 사슬로 구성됩니다.경쇄 및 중쇄는 분자량에 따라 이름이 지정됩니다.Y자형 구조의 상단은 항원 결합 부위인 가변 영역입니다.(Detai Bio-Monoclonal Antibody Concept에서 발췌)
항체 구조
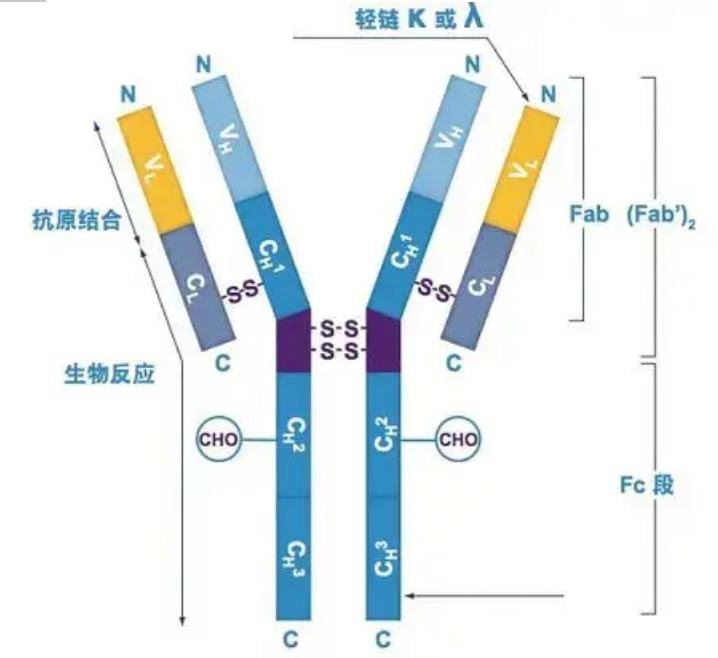 중쇄
중쇄
그리스 문자 α, δ, ε, γ 및 μ로 명명된 5가지 유형의 포유류 Ig 중쇄가 있습니다.해당 항체는 IgA, IgD, IgE, IgG 및 IgM이라고합니다.서로 다른 중쇄는 크기와 구성이 다릅니다.α와 γ는 약 450개의 아미노산을 포함하고 μ와 ε는 약 550개의 아미노산을 포함합니다.
각 중쇄에는 불변 영역과 가변 영역의 두 영역이 있습니다.동일한 유형의 모든 항체는 동일한 불변 영역을 갖지만 유형이 다른 항체 간에는 차이가 있습니다.중쇄 γ, α 및 δ의 불변 영역은 유연성을 증가시키기 위한 경첩 영역과 함께 3개의 Ig 도메인으로 구성됩니다.중쇄 μ 및 ε의 불변 영역은 4개의 Ig 도메인으로 구성된다.상이한 B 세포에 의해 생성된 항체의 중쇄 가변 영역은 다르지만, 동일한 B 세포 또는 세포 클론에 의해 생성된 항체의 가변 영역은 동일하며, 각 중쇄의 가변 영역은 길이가 약 110개 아미노산이다., 그리고 단일 Ig 도메인을 형성합니다.
경쇄
포유류에는 람다형과 카파형의 두 가지 유형의 경쇄만 있습니다.각 경쇄에는 두 개의 연결된 도메인, 즉 불변 영역과 가변 영역이 있습니다.경쇄의 길이는 약 211~217개의 아미노산이다.각 항체에 포함된 두 개의 경쇄는 항상 동일합니다.포유류의 경우 각 항체의 경쇄에는 카파 또는 람다의 한 가지 유형만 있습니다.연골 어류(연골 어류) 및 경골어류와 같은 일부 하등 척추동물에서는 이오타(iota) 유형과 같은 다른 유형의 경쇄도 발견됩니다.
Fab 및 Fc 세그먼트
Fc 세그먼트는 효소 또는 형광 염료와 직접 결합하여 항체에 라벨을 붙일 수 있습니다.ELISA 과정에서 항체가 플레이트에 고정되는 부분이며, 면역침전법, 면역블로팅법, 면역조직화학법에서 2차 항체가 인식되어 결합되는 부분이기도 하다.항체는 파파인과 같은 단백질 분해 효소에 의해 두 개의 F(ab) 세그먼트와 하나의 Fc 세그먼트로 가수분해될 수 있거나, 펩신에 의해 힌지 영역에서 분해되어 하나의 F(ab)2 세그먼트와 하나의 Fc 세그먼트로 가수분해될 수 있습니다.IgG 항체 조각은 때때로 매우 유용합니다.Fc 세그먼트가 없기 때문에 F(ab) 세그먼트는 항원과 함께 침전되지 않으며 생체 내 연구에서 면역 세포에 의해 포착되지도 않습니다.작은 분자 조각과 가교 기능의 부족(Fc 세그먼트 부족으로 인해)으로 인해 Fab 세그먼트는 일반적으로 기능 연구에서 방사성 표지에 사용되며 Fc 세그먼트는 주로 조직 화학 염색에서 차단제로 사용됩니다.
가변 및 상수 영역
가변 영역(V 영역)은 N-말단 근처 H 사슬의 1/5 또는 1/4(약 118개 아미노산 잔기 함유) 및 L 사슬의 N-말단 근처 1/2(약 108-111개 아미노산 잔기 함유)에 위치한다.각 V 영역에는 사슬 내 이황화 결합에 의해 형성된 펩티드 고리가 있으며 각 펩티드 고리에는 약 67~75개의 아미노산 잔기가 포함되어 있습니다.V 영역의 아미노산 구성 및 배열은 항체의 항원 결합 특이성을 결정합니다.끊임없이 변화하는 V 영역의 아미노산 유형 및 서열로 인해 결합 항원 특이성이 다른 많은 종류의 항체가 형성될 수 있습니다.L 사슬과 H 사슬의 V 영역은 각각 VL과 VH로 불린다.VL 및 VH에서 일부 국소 영역의 아미노산 조성 및 서열은 더 높은 정도의 변이를 갖는다.이러한 영역을 초가변 영역(HVR)이라고 합니다.V 영역에서 non-HVR 부분의 아미노산 구성 및 배열은 상대적으로 보존적이며 이를 프레임워크 영역이라고 합니다.VL에는 일반적으로 각각 아미노산 잔기 24-34 및 89-97에 위치한 3개의 초가변 영역이 있습니다.VL 및 VH의 3개의 HVR은 각각 HVR1, HVR2 및 HVR3으로 불린다.X선 결정 회절을 연구 분석한 결과 초가변 영역이 바로 항체 항원이 결합하는 곳이라는 사실이 밝혀져 상보성 결정 영역(CDR)이라고 불린다.VL 및 VH의 HVR1, HVR2 및 HVR3은 각각 CDR1, CDR2 및 CDR3이라고 할 수 있습니다.일반적으로 CDR3는 높은 정도의 초가변성을 가지고 있습니다.초가변 영역은 Ig 분자의 이디오타입 결정인자가 존재하는 주요 위치이기도 합니다.대부분의 경우 H 사슬은 항원에 결합하는 데 더 중요한 역할을 합니다.
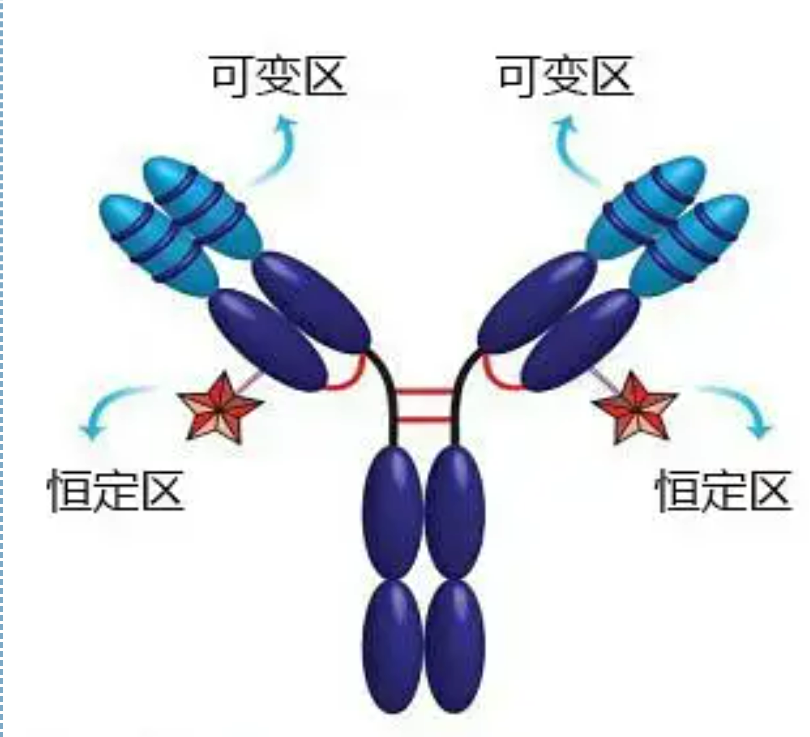 상수 영역(C 영역)C 말단 근처 H 사슬의 3/4 또는 4/5(대략 아미노산 119에서 C 말단까지) 및 L 사슬의 C 말단 근처 1/2(약 105개의 아미노산 잔기 함유)에 위치한다.H 사슬의 각 기능 영역은 약 110개의 아미노산 잔기를 포함하고 이황화 결합으로 연결된 50-60개의 아미노산 잔기로 구성된 펩티드 고리를 포함합니다.이 영역의 아미노산 구성 및 배열은 동일한 동물 Ig 이소형 L 사슬 및 동일한 유형 H 사슬에서 상대적으로 일정합니다.마찬가지로 해당 항원에만 특이적으로 결합할 수 있지만 C 영역의 구조는 동일합니다. 즉 동일한 항원성을 갖습니다.말 항-인간 IgG 2차 항체(또는 항-항체)는 2개의 다른 외독소에 대한 항체(IgG)의 조합이 발생한다.이것은 2차 항체를 준비하고 플루오레세인, 동위원소, 효소 및 기타 표지된 항체를 적용하기 위한 중요한 기초입니다.
상수 영역(C 영역)C 말단 근처 H 사슬의 3/4 또는 4/5(대략 아미노산 119에서 C 말단까지) 및 L 사슬의 C 말단 근처 1/2(약 105개의 아미노산 잔기 함유)에 위치한다.H 사슬의 각 기능 영역은 약 110개의 아미노산 잔기를 포함하고 이황화 결합으로 연결된 50-60개의 아미노산 잔기로 구성된 펩티드 고리를 포함합니다.이 영역의 아미노산 구성 및 배열은 동일한 동물 Ig 이소형 L 사슬 및 동일한 유형 H 사슬에서 상대적으로 일정합니다.마찬가지로 해당 항원에만 특이적으로 결합할 수 있지만 C 영역의 구조는 동일합니다. 즉 동일한 항원성을 갖습니다.말 항-인간 IgG 2차 항체(또는 항-항체)는 2개의 다른 외독소에 대한 항체(IgG)의 조합이 발생한다.이것은 2차 항체를 준비하고 플루오레세인, 동위원소, 효소 및 기타 표지된 항체를 적용하기 위한 중요한 기초입니다.
관련 상품:
셀 다이렉트 RT-qPCR 키트
게시 시간: 2021년 9월 30일








