1. 초기 이해
이 단계에서 우리는 선배들 앞에서 다음과 같은 실수를 하지 않기 위해 몇 가지 개념과 용어를 이해해야 합니다.
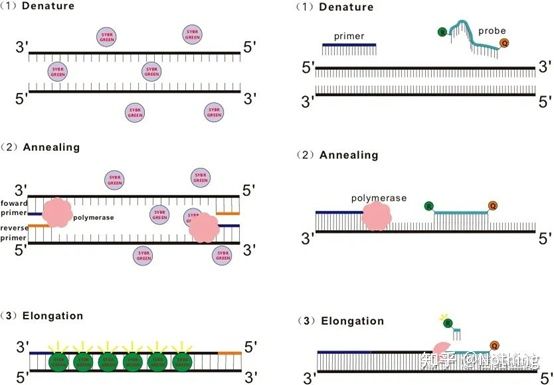
Q: RT-PCR, qPCR, Real-time PCR, real-time RT-PCR의 차이점은 무엇인가요?
답변: RT-PCR은 역전사 PCR입니다.(역전사 PCR, RT-PCR)은 중합효소 연쇄반응(PCR)의 널리 사용되는 변종입니다.RT-PCR은 RNA가닥을 상보적인 DNA로 역전사한 후 PCR에 의한 DNA 증폭을 위한 주형으로 사용합니다.
실시간 PCR 및 qPCR(Quantitative Real-time-PCR)은 모두 실시간 정량 PCR입니다. 즉, PCR의 각 주기에는 실시간 데이터 기록이 있으므로 시작 템플릿의 수를 조정하여 정확한 분석을 할 수 있습니다.
Real-time PCR(실시간 형광 정량적 PCR) 및 역전사 PCR(역전사 PCR)은 둘 다 RT-PCR로 약칭되는 것처럼 보이지만 국제 관례는 다음과 같습니다.PCR , Real-time PCR은 일반적으로 qPCR(quantitative real-time PCR)로 약칭됩니다..
그리고 실시간 RT-PCR(RT-qPCR), 형광 정량 기술이 결합된 역전사 PCR이다.: 먼저 RNA 역전사로부터 cDNA(RT)를 얻은 후 정량 분석(qPCR)을 위해 Real-time PCR을 사용합니다.대부분의 실험실에서 RT-qPCR, 즉 RNA 발현 하향 조절에 대한 연구를 하기 때문에 실험실에서 모두가 이야기하는 qPCR은 사실 RT-qPCR을 지칭하지만, 임상 적용에는 여전히 많은 DNA 검사가 있다는 것을 잊지 마십시오.B형 간염 바이러스 HBV 검출과 같은 정량 분석.
Question: 형광 정량 PCR을 많이 읽은 후 왜 증폭된 fragment를 80-300bp 범위 내에서 조절해야 하나요?
답변: 유전자 염기서열마다 길이가 다른데 어떤 것은 몇 kb, 어떤 것은 수백 bp인데 프라이머를 디자인할 때 산물의 길이는 80-300bp 정도만 요구하면 되는데, 너무 짧거나 너무 길면 형광 정량 PCR 검출에 적합하지 않다.생성물 조각이 너무 짧아서 프라이머-다이머와 구별할 수 없습니다.Primer-dimer의 길이는 30~40bp 정도이며 80bp 미만이면 primer-dimer인지 product인지 구분하기 어렵다.산물 조각이 너무 길어 300bp를 초과하면 증폭 효율이 낮아지기 쉽고 유전자 양을 효과적으로 검출할 수 없습니다.
예를 들어 교실에 있는 사람의 수를 셀 때 입이 몇 개인지 세기만 하면 됩니다.유전자를 검출할 때도 마찬가지입니다. 유전자의 특정 서열을 검출하기만 하면 전체 서열이 됩니다.사람을 세고 싶다면 입과 코, 귀, 안경을 모두 세어야 하고 실수하기 쉽습니다.
확장하자면, 생물학적 연구에서는 특정 종의 유전자 서열이 매우 길기 때문에 모든 단편을 측정하는 것이 불필요하고 불가능합니다. 예를 들어 박테리아의 보존적 서열을 수행하는 박테리아 16S 시퀀싱 특정 박테리아 집단의 수를 추론하기 위한 분석입니다.
Q: qPCR primer 디자인을 위한 최적의 길이는 얼마인가요?
답변: 일반적으로 primer length는 20-24bp 정도가 적당합니다.물론 Primer 설계 시 Primer의 TM 값은 최적 Annealing 온도와 관련이 있기 때문에 주의를 기울여야 합니다.많은 실험 후에 60°C가 더 나은 TM 값이라는 것이 입증되었습니다.어닐링 온도가 너무 낮으면 비특이적 증폭이 쉽게 발생합니다.어닐링 온도가 너무 높으면 증폭 효율이 상대적으로 낮아지고 증폭 곡선의 피크가 나중에 시작되며 CT 값이 지연됩니다.
Q: 염색법은 탐침법과 어떻게 다릅니까?
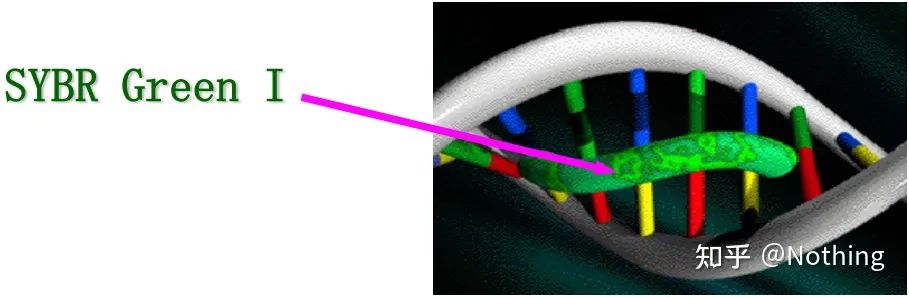
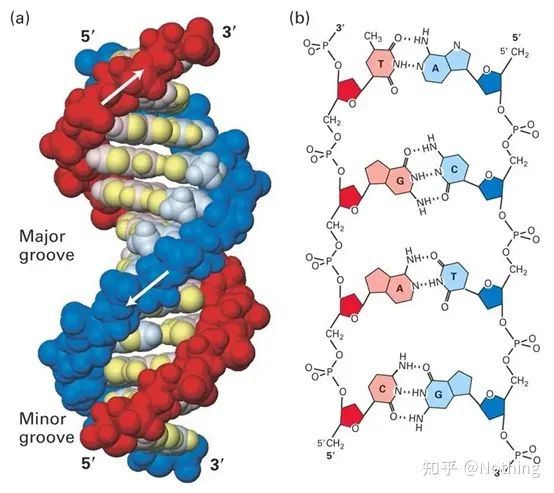
답: 염색법SYBR Green Ⅰ, PicoGreen, BEBO 등과 같은 일부 형광 염료는 자체적으로 발광하지 않지만 이중 가닥 DNA의 작은 홈에 결합한 후 형광을 방출합니다.따라서 PCR 반응 초기에는 기계가 형광 신호를 감지할 수 없습니다.반응이 어닐링-연장 단계에 도달하면 이중 가닥이 열리고 DNA 중합효소의 작용으로 새로운 가닥이 합성되며 형광 분자가 dsDNA 마이너 그루브에 결합합니다.PCR 사이클이 증가할수록 이중가닥 DNA와 결합하는 염료가 점점 더 많아지고 형광 신호도 지속적으로 강화된다.염료 방법은 주로 과학 연구에 사용됩니다.
추신: 실험을 할 때 주의하세요. 염료는 인간의 DNA와 결합해야 합니다. 형광 사람으로 바뀌지 않도록 주의하세요.
염색법(좌) 탐침법(우)
추신: 실험을 할 때 주의하세요. 염료는 인간의 DNA와 결합해야 합니다. 형광 사람으로 바뀌지 않도록 주의하세요.
SYBR Green Ⅰ은 DNA의 마이너 그루브에 결합
프로브 방법Taqman 프로브는 가장 일반적으로 사용되는 가수분해 프로브입니다.프로브의 5' 말단에는 일반적으로 FAM인 형광 그룹이 있으며 프로브 자체는 표적 유전자에 상보적인 서열입니다.3' 말단에 형광 소광기가 있다.형광 공명 에너지 전달(Förster resonance energy transfer, FRET) 원리에 따르면, 리포터 형광 그룹(공여 형광 분자)과 소광 형광 그룹(억셉터 형광 분자)이 여기될 때 스펙트럼이 중첩되고 거리가 매우 가까울 때(7-10nm) 도너 분자의 여기가 억셉터 분자의 형광을 유도할 수 있는 반면, 자가 형광은 약해집니다.따라서 PCR 반응 초기에 프로브가 시스템에서 자유롭고 온전할 때 리포터 형광 그룹은 형광을 방출하지 않습니다.어닐링 시 프라이머와 프로브가 템플릿에 결합합니다.연장 단계에서 중합효소는 지속적으로 새로운 사슬을 합성합니다.DNA 중합효소는 5'-3' 엑소뉴클레아제 활성을 가지고 있습니다.프로브에 도달하면 DNA 폴리머라제가 템플릿에서 프로브를 가수분해하고 리포터 형광 그룹을 소광제 형광 그룹에서 분리하고 형광 신호를 방출합니다.탐침과 주형은 일대일 관계이기 때문에 탐침법이 염색법보다 검사의 정확도와 민감도 면에서 우수하다.프로브 방법은 주로 진단에 사용됩니다.
Q: 절대 정량화란 무엇입니까?상대 정량화란 무엇입니까?
답변: 절대정량이란 혈액 1ml에 HBV 바이러스가 몇 개인지 등 qPCR로 검사할 검체의 초기 복제수를 계산하는 것을 말합니다.상대적인 정량화로 얻은 결과는 다른 참조 샘플에 비해 특정 샘플의 표적 유전자 양의 변화이며 유전자 발현은 상향 조절되거나 하향 조절됩니다.
Q: RNA 추출량, 역전사 효율, 증폭 효율이 실험 결과에 영향을 주나요?
Q: 시료 보관, 추출 시약, 역전사 시약, 투광성 소모품이 실험 결과에 영향을 주나요?
Q: 실험 데이터를 수정할 수 있는 방법은 무엇입니까?
이러한 문제에 대해서는 아래의 고급 및 고급 섹션에서 자세히 설명합니다.
2. 고급 지식
실시간 형광 정량 PCR과 관련하여 우리는 매년 수천 편의 과학 연구 논문이 발표되고 그 중 형광 정량 PCR 기술이 적지 않은 현실을 인식해야 합니다.
형광 정량 PCR 실험을 측정하는 공통 표준이 없는 경우 결과가 크게 다를 수 있습니다.같은 종의 같은 유전자라도 같은 처리 방법으로 검출 결과도 천차만별이어서 후발주자가 같은 결과를 반복하기는 어려울 것이다.어느 것이 옳고 그른지는 아무도 모릅니다.
이것은 형광 정량 PCR이 치트 기술이거나 신뢰할 수 없는 기술이라는 것을 의미합니까?아니요, 형광 정량 PCR이 더 민감하고 정확하기 때문에 약간의 잘못된 조작으로 완전히 반대의 결과가 나오기 때문입니다.작은 손실은 수천 마일 떨어져 있습니다..기사 작성자는 리뷰어에게 반복적으로 고문을 당할 수 있습니다.동시에 저널의 검토자도 다양한 실험 결과 중에서 선택하기가 어렵습니다.
대체로 실시간 PCR 실험에서 합의가 부족하다는 점을 지적합니다.이를 위해 업계의 선임 과학자들은 표준을 공식화하기 시작했으며,기여자가 이러한 표준을 충족하기 위해 필요한 실험 및 데이터 처리 세부 정보(필요한 데이터 포함)를 기사에 제공하도록 요구합니다.
검토자는 이러한 세부 정보를 읽고 실험의 품질을 판단할 수 있습니다.미래의 독자들도 이것을 사용하여 실험을 반복하거나 실험을 개선할 수 있습니다.그런 다음 이러한 방식으로 얻은 실험 결과는 정보가 풍부하고 고품질이며 사용 가능합니다.
MIBBI(생물학적 및 생물의학 조사를 위한 최소 정보 -http://www.mibbi.org)가 생겼습니다.MIBBI는 실험을 위한 표준을 제공하는 프로젝트입니다..그것은 자연에서 출판됩니다.본 프로젝트는 세포생물학, Microarray, 지금부터 논의할 qPCR 등 다양한 생물학적 실험을 대상으로 하며 원고 제출 시 실험 유형별로 제공한다.해당 정보는 항상 제공되어야 합니다.
MIBBI 프로젝트에는 형광 정량 PCR과 관련된 두 개의 기사가 있습니다.:
·RDML(Real-Time PCR Data Markup Language) – 실시간 정량 PCR 데이터를 위한 구조화된 언어 및 보고 가이드;
·MIQE (Minimum Information for Publication of Quantitative Real-Time PCR Experiments) – 실시간 정량 PCR 실험에 대한 기사를 게재하기 위한 최소한의 정보.
먼저 용어 사양인 RDML에 대해 이야기해 보겠습니다.
모든 것에 대한 표준 정의가 없으면 토론을 계속할 수 없기 때문에 시험에서 용어 설명이 매우 중요합니다.
형광 정량 PCR 실험에서 사용되는 용어는 다음과 같은 내용을 포함한다.QIAGEN은 우리를 위해 최고의 요약을 만들었습니다.다음은 모두 건조상품 .
증폭 곡선
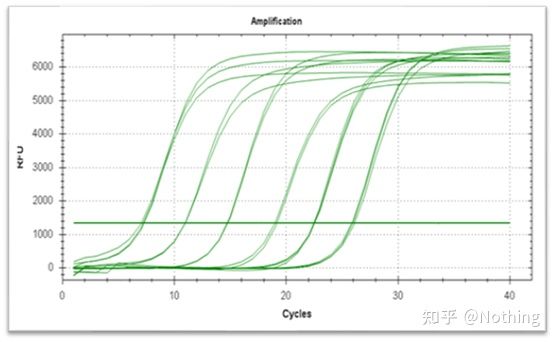
증폭곡선은 PCR 과정에서 만들어진 곡선을 말하며, 횡축은 사이클 수, 종축은 반응 중 실시간 형광강도이다.
우수한 증폭 곡선은 다음과 같은 특성을 가져야 합니다.: 기준선이 평평하거나 약간 감소하고 뚜렷한 상승 추세가 없습니다.곡선의 변곡점이 명확하고 지수 위상의 기울기가 증폭 효율에 비례합니다.기울기가 클수록 증폭 효율이 높아집니다.전체 증폭 곡선 평행도가 양호하여 각 튜브의 증폭 효율이 유사함을 나타냅니다.저농도 샘플의 증폭 곡선의 지수 위상은 명백합니다.
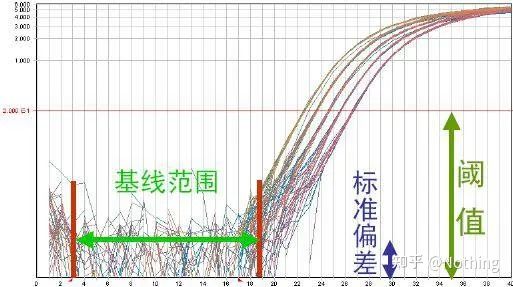
기준선(기준선)
기준선은 초기 주기의 소음 수준입니다., 일반적으로 3~15주기 사이에 측정하는데, 이 기간 동안 증폭 산물에 의한 형광 값 증가를 감지할 수 없기 때문입니다.기준선을 계산하는 데 사용되는 주기 수는 다양할 수 있으며 템플릿 양이 많이 사용되거나 표적 유전자의 발현 수준이 높은 경우 감소해야 할 수 있습니다.
기준선을 설정하려면 선형성 증폭 곡선에서 형광 데이터를 확인해야 합니다.기준선은 증폭 곡선의 성장이 기준선 주기 최고 수보다 큰 주기 수로 시작하도록 설정됩니다.기준선은 각 대상 시퀀스에 대해 개별적으로 설정해야 합니다.초기 사이클에서 검출된 평균 형광 값은 증폭된 제품에서 얻은 형광 값에서 빼야 합니다.최신 버전의 다양한 Real-Time PCR 소프트웨어를 사용하면 개별 샘플에 대한 기본 설정을 자동으로 최적화할 수 있습니다.
PCR 증폭 반응의 처음 몇 사이클 동안 형광 신호는 많이 변하지 않습니다.직선에 접근하는 것을 기준선이라고 하지만 처음 몇 주기를 자세히 보면 기준선 내에서 아래 그림에서 일어나는 일이 있음을 알 수 있습니다.
배경 배경은 다음을 가리킨다.
반응의 비특이적 형광 값 .예: 비효율적인 형광 소광;또는 SYBR Green의 사용으로 인해 많은 수의 이중 가닥 DNA 템플릿.신호의 배경 구성 요소는 Real-Time PCR 소프트웨어 알고리즘에 의해 수학적으로 제거됩니다.
기자 신호
리포터 신호는 Real-Time PCR 동안 SYBR Green 또는 형광 표지된 서열 특이적 프로브에 의해 생성된 형광 신호를 말합니다.
정규화된 리포터 신호(RN)
RN은 각 주기에서 측정된 수동 참조 염료의 형광 강도로 나눈 리포터 염료의 형광 강도를 나타냅니다.
패시브 참조 염료
일부 Real-Time PCR에서,형광 염료 ROX는 형광 신호를 정규화하기 위한 내부 참조로 사용됩니다..부정확한 피펫팅, 웰 위치 및 웰 단위의 형광 변동으로 인한 변화를 보정합니다.
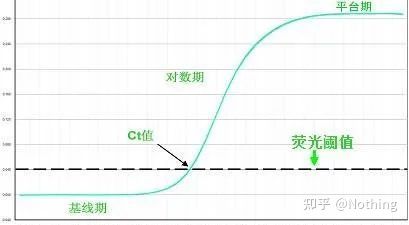
형광 임계값(threshold)
배경 값보다 높고 증폭 곡선의 안정기 값보다 훨씬 낮게 조정되었습니다.PCR 검출의 로그 선형 범위를 나타내는 증폭 곡선의 선형 영역에 있어야 합니다.PCR의 로그 선형 단계를 쉽게 식별할 수 있도록 로그 증폭 곡선 보기에서 임계값을 설정해야 합니다.Real-Time PCR에 target 유전자가 여러 개인 경우 각 target에 대해 threshold를 설정해야 합니다.일반적으로 PCR 반응의 처음 15주기의 형광 신호를 형광 배경 신호로 사용하며, 형광 역치는 PCR의 처음 3~15주기의 형광 신호의 표준편차의 10배이며 형광 역치는 PCR 증폭의 지수 위상(exponential phase)으로 설정된다.일반적으로 각 기기에는 사용 전에 형광 임계값이 설정되어 있습니다.
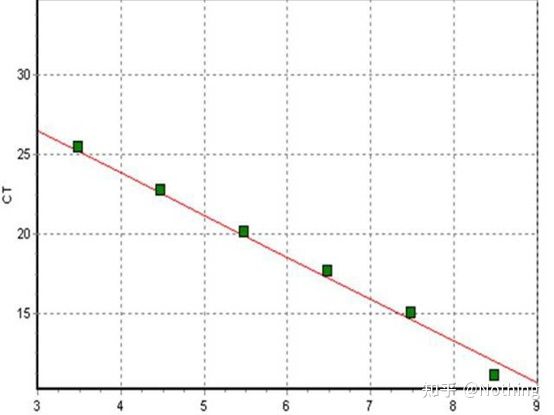
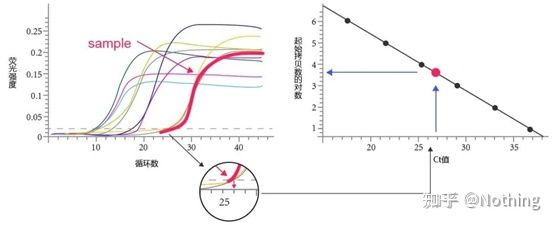
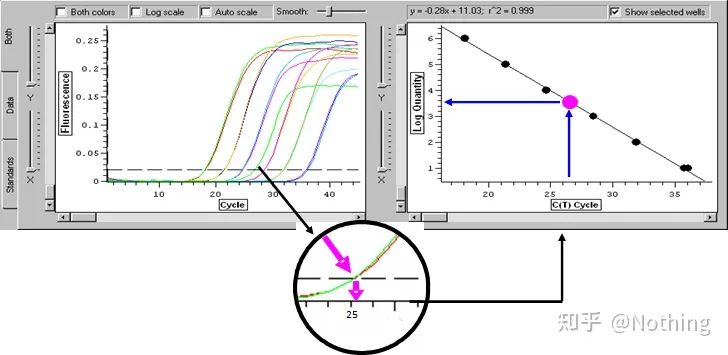
주기 임계값(CT) 또는 교차점(CP)
증폭 곡선이 임계값을 교차하는 주기(즉, 형광 검출이 크게 증가하는 지점).CT는 분수가 될 수 있으며 시작 템플릿의 양을 계산할 수 있습니다.CT 값은 각 PCR 반응 튜브의 형광 신호가 설정된 임계값에 도달할 때 경험하는 주기 수를 나타냅니다.각 템플릿의 CT 값과 템플릿의 초기 사본 수의 로그 사이에는 선형 관계가 있습니다.초기 사본 수가 높을수록 CT 값이 작아지고 그 반대도 마찬가지입니다..초기 카피 수를 알고 있는 표준을 사용하여 표준 곡선을 만들 수 있으며, 가로 좌표는 CT 값을 나타내고 세로 좌표는 초기 카피 수의 로그를 나타냅니다.따라서 미지 시료의 CT 값만 구하면 표준 곡선에서 시료의 초기 사본 수를 계산할 수 있습니다.
ΔCT 값
ΔCT 값 설명대상 유전자와 해당 내인성 참조 유전자 CT 값의 차이, 하우스키핑 유전자와 같이 사용되는 템플릿의 양을 정규화하는 데 사용됩니다.
⇒ΔCT = CT(표적 유전자) – CT(내인성 참조 유전자)
ΔΔCT 값
ΔΔCT 값은 관심 샘플(예: 자극된 세포)의 평균 ΔΔCT 값과 참조 샘플(예: 자극되지 않은 세포)의 평균 ΔΔCT 값 간의 차이를 설명합니다.참조 샘플은 보정 샘플이라고도 하며 다른 모든 샘플은 상대 정량화를 위해 이것으로 정규화됩니다.
⇒ΔΔCT = 평균 ΔCT(관심 샘플) – 평균 ΔCT(참조 샘플)
내인성 참조 유전자(내인성 참조 유전자)
하우스키핑 유전자(housekeeping gene)와 같은 내인성 참조 유전자의 발현 수준은 샘플 간에 차이가 없습니다.참조 유전자의 CT 값을 대상 유전자와 비교하면 대상 유전자의 발현 수준을 입력 RNA 또는 cDNA의 양으로 정규화할 수 있습니다(위의 ΔCT 값 섹션 참조).
다음에 대한 올바른 내부 참조 유전자가능한 RNA 분해 또는 RNA 샘플 내 효소 억제제의 존재, RNA 함량의 변화, 역전사 효율, 핵산 회수 및 샘플 취급.최적의 참조 유전자를 선택하기 위해 실험 설정에 따라 최적의 참조 유전자를 선택할 수 있도록 알고리즘을 수정했습니다.
내부통제
표적 서열과 동일한 반응에서 증폭되고 다른 프로브로 프로브되는 제어 서열(즉, 듀플렉스 PCR 수행).내부 통제는 표적 서열이 검출되지 않는 경우와 같이 실패한 증폭을 배제하기 위해 종종 사용됩니다.
교정 샘플
유전자의 상대적 발현 수준을 결정하기 위해 다른 모든 샘플을 비교하기 위해 상대적 정량화에 사용되는 참조 샘플(예: 세포주 또는 조직에서 정제된 RNA).보정 샘플은 모든 샘플이 될 수 있지만 일반적으로 대조군입니다(예: 처리되지 않은 샘플 또는 실험 시간 0의 샘플).
양성 대조군
와 제어 반응을 사용템플릿의 알려진 양.양성 대조군은 종종 프라이머 세트 또는 프라이머-프로브 세트가 제대로 작동하고 반응이 올바르게 설정되었는지 확인하는 데 사용됩니다.
템플릿 제어 없음(NTC)
일반적으로 물로 대체되는 주형을 제외한 증폭 반응의 모든 필수 구성 요소를 포함하는 대조 반응.NTC를 사용하면 시약 오염 또는 외부 DNA로 인한 오염을 찾을 수 있으므로 검출 데이터의 진정성과 신뢰성을 보장할 수 있습니다.NTC 컨트롤의 증폭은 오염을 나타냅니다.
RT 제어 없음(NRT)
RNA 추출 과정은 매우 유해하고 데이터 품질에 영향을 미치는 주범이자 qPCR의 천적인 잔여 genomic DNA를 포함할 수 있으므로 실험을 설계할 때 RNA 검출만을 증폭하도록 설계되어야 합니다.두 가지 방법이 있는데, 하나는 인트론을 가로질러 프라이머를 디자인하는 것이고, 다른 하나는 DNA를 완전히 제거하는 것인데 어느 쪽이 더 나은지 나중에 논의할 것입니다.NTR 컨트롤은 DNA 오염을 감지하는 마법의 거울입니다.증폭이 있으면 오염이 있음을 의미합니다.
표준
표준은 표준 곡선을 구성하는 데 사용되는 알려진 농도 또는 복제 수의 샘플입니다.표준품의 안정성을 확보하기 위해 일반적으로 유전자 조각을 플라스미드에 클로닝하여 표준품으로 사용합니다.
표준 곡선
보통 배가 비율에 따라 표준품과 최소 5 농도 구배로 희석하고 CT 값과 카피 수의 좌표에 5개의 점을 그리고 그 점들을 연결하여 선을 형성하여 표준 곡선을 생성합니다.각 표준 곡선에 대해 유효성을 확인해야 합니다.기울기 값은 -3.3과 -3.8 사이이며 각 농도는 3회 수행됩니다.다른 포인트와 현저하게 다른 포인트는 버려야 합니다.테스트할 샘플의 CT 값을 표준 곡선으로 가져오고 테스트할 샘플의 발현 수준을 계산할 수 있습니다.
테스트할 샘플의 CT 값을 표준 곡선으로 가져오고 테스트할 샘플의 초기 사본 수를 계산할 수 있습니다.
효율성과 기울기
표준 곡선의 기울기는 실시간 PCR의 효율성을 나타냅니다.
·-3.322의 기울기는 PCR 증폭 효율이 1 또는 100% 효율이며 각 사이클에서 PCR 생성물의 양이 두 배로 증가함을 나타냅니다.
·-3.322 미만의 기울기(예: -3.8)는 PCR 효율을 나타냅니다.
·-3.322보다 큰 기울기(예: -3.0)는 PCR 효율이 100%보다 큰 것으로 나타나는데, 한 사이클의 PCR이 어떻게 두 배 이상의 증폭 산물을 생성할 수 있는지 궁금합니다.이러한 상황은 PCR 반응의 비선형 단계, 즉 비특이적 증폭이 많은 단계에서 발생합니다.
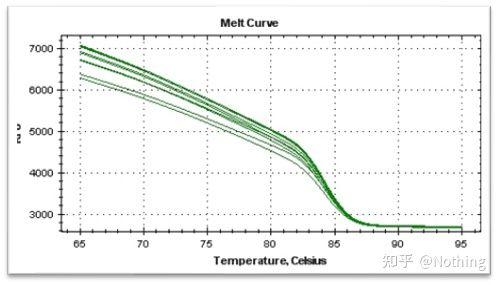
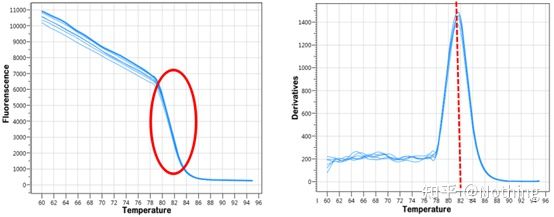
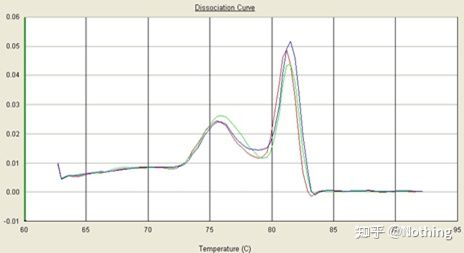
녹는 곡선
qPCR 증폭이 완료되면 PCR 산물을 가열합니다.온도가 상승함에 따라 이중 가닥 증폭 산물이 서서히 녹아 형광 강도가 감소합니다.특정 온도(Tm)에 도달하면 많은 수의 제품이 녹습니다.형광이 급격히 떨어집니다.다른 PCR 제품은 다른 Tm 값과 다른 용융 온도를 가지므로 PCR의 특이성을 확인할 수 있습니다.
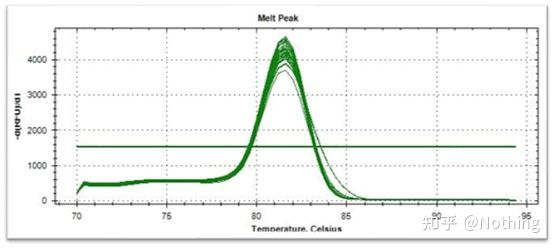
녹는 곡선(미분 곡선)
용융 곡선을 도출하여 피크 맵을 형성하여 PCR 산물 조각의 상황을 보다 직관적으로 표시할 수 있습니다.녹는 온도는 DNA 절편의 Tm 값이므로 절편 크기, GC 함량 등과 같이 DNA 절편의 Tm 값에 영향을 미치는 일부 매개변수를 판단할 수 있습니다. 일반적으로 말하자면, 당사의 프라이머 설계 원칙에 따라,증폭된 산물의 길이는 80-300bp 범위이므로 녹는 온도는 80°C에서 90°C 사이여야 합니다.
용융 곡선의 해석: 80°C-90°C 사이에 주요 피크만 나타나면 형광 정량 PCR이 완벽함을 의미합니다.주 피크가 80°C-90°C 사이에 나타나고 기타 피크가 80°C 아래에 나타나면 기본적으로 프라이머 이합체가 고려됩니다.이를 해결하기 위해 어닐링 온도를 높일 수 있습니다.80°C-90°C 사이에서 주요 피크가 나타나고 온도가 상승할 때 기타 피크가 다시 나타나면 기본적으로 DNA 오염이 있는 것으로 간주되며 실험 초기 단계에서 DNA를 제거해야 합니다.
물론 여전히 비정상적인 상황이 있으며 아래에서 하나씩 세분화됩니다.
3. 고급 지식
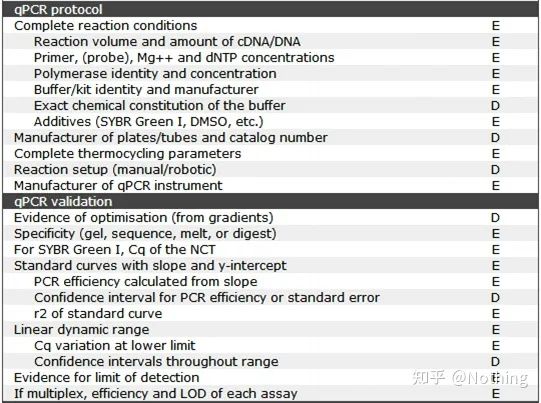
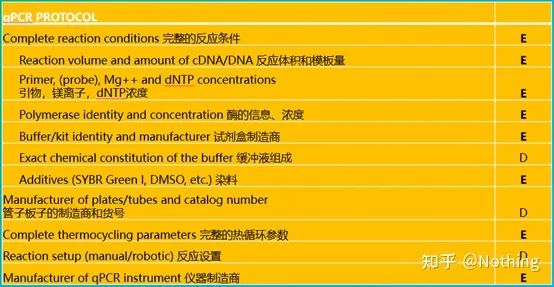
qPCR을 하려면 MIQE라고 해야 하는데,최소 정보출판을 위해양적실시간 PCR실험 - 실시간 정량적 PCR에 대한 논문 게재를 위한 최소한의 정보실험 .모든 사람의 이해를 단순화하기 위해 주요 내용을 단순화합니다.
인터넷에서 MIQE의 원문을 검색할 수 있으며 가장 중요한 것은기사 게재 시 제공해야 하는 데이터 체크리스트 .
검토자는 이러한 세부 정보를 읽고 실험의 품질을 판단할 수 있습니다.미래의 독자는 이것을 사용하여 실험을 반복하거나 개선할 수도 있습니다.
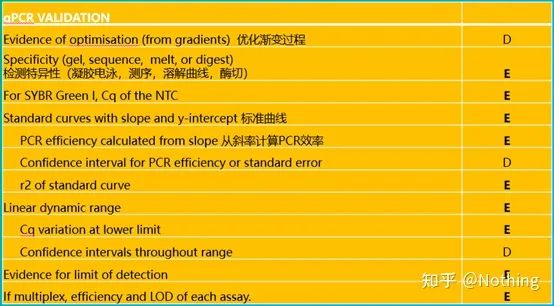
이 목록에서 각 목록의 중요도는 각각 E 또는 D로 표시됩니다.무슨 뜻이에요?E: 필수 정보(제출해야 함)D: 바람직한 정보(가능한 한 많이 제공).
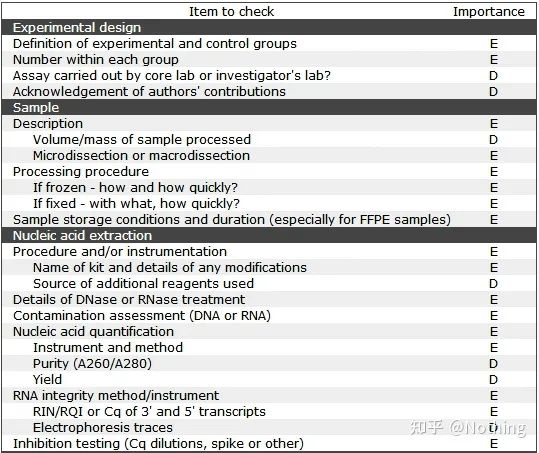
MIQE(1) - 실험 설계
대학원 과정을 마친 후 변호를 마친 많은 쓰레기들은 독립적으로 실험을 설계하고, 공책을 펴고, 교사가 시키는 대로 하는 방법을 알지 못할 것입니다.그러다 보니 실험 설계가 까다롭지 않았고, 잡지 편집부는 이 사진 저 사진을 합성하고 싶다고 해서 멍하니 했다.만두피는 이렇게 만들어집니다!
가정에 더 가까운 실험의 첫 번째 원칙은 다음을 결정하는 것입니다.실험 논리의 엄격함.가장 기본이 되는 것은 실험 설계이며, 실험 설계에서 가장 중요한 것은 실험 데이터를 참조할 수 있고 비교 가능하며 설득력이 있도록 대상 샘플, 참조 샘플(대조군), 반복 횟수를 설정하는 방법입니다.
대상 샘플특정 처리 후 표적 유전자를 검출해야 하는 샘플을 의미합니다.참조 샘플어떠한 처리도 하지 않은 샘플로 생물학에서 야생형이라고 많이 합니다.
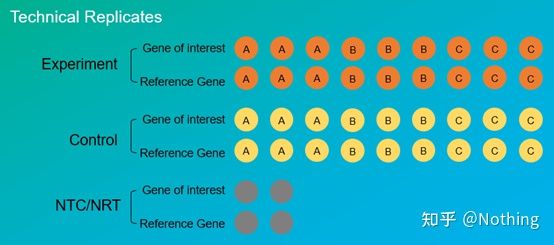
실험 복제매우 중요합니다.일반적으로 설득력 있는 반복 횟수는 3회 이상이어야 합니다.생물학적 복제와 기술적 복제를 구별할 필요가 있다.
생물학적 복제물: 다른 재료(시간, 식물, 배치, 반응 플레이트)로 동일한 검증 실험을 수행했습니다.
생물학적 복제
후추의 농약 처리를 예로 들어 보겠습니다.우리는 ABC의 3개 식물에 살충제를 뿌리고자 하고, ABC의 3개 식물은 3개의 생물학적 복제물이며, 서로 다른 물질로 수행된 동일한 검증 실험입니다.그러나 실험으로서 대조군이 반드시 필요하므로 식물 A의 가지 중 하나에 살포하여 식물 A의 실험군을 형성하고 식물 A의 다른 가지에 살포하지 않고 대조군을 형성할 수 있다.B와 C에 대해 동일한 작업을 수행합니다.
기술적 복제품(Technical Replicates): 조작에 의한 오차를 피하기 위해 고안된 반복 실험으로, 실제로는 동일한 재질에 포함된 중복 구멍입니다.치료와 대조군 모두 대상 유전자와 내부 참조 유전자의 복제 설정(최소 3개)이 있어야 합니다.
기술적 반복
살충제로 처리된 고추를 다시 예로 들어보자.식물 A의 실험군에 대해 target 유전자와 내부 참조 유전자에 대해 각각 1, 2, 3의 3개의 PCR 구멍을 만들어 검출 후 평균을 구했습니다.플랜트 A의 제어를 위해 그룹도 동일한 방식으로 처리됩니다.마찬가지로 B와 C 식물에 대해 동일한 처리를 수행합니다.이것은 기술적인 반복입니다.
주목할 가치가 있습니다통계에 들어가는 것은 생물학적 반복이고, 기술적 반복은 실험 과정에서 임의의 현상이 있는지 테스트하여 실험 결과를 신뢰할 수 있게 만드는 것, 즉 우리가 흔히 말하는 평균을 취하여 오류를 피하는 것입니다.
음성 대조군 - NTC 및 NRT
NTC(템플릿 없는 제어)실험물질의 오염 여부를 확인하기 위해 템플릿이 없는 컨트롤인 를 사용합니다.일반적으로 물은 템플릿으로 사용됩니다.형광 반응이 있으면 실험실에서 핵산 오염이 발생했음을 나타냅니다.
이러한 오염은 불순물, 내인성 DNA를 포함하는 부적격 시약, 프라이머 오염, 실험실 장비 오염, 에어로졸 오염 등에서 발생하며 RNase 스캐빈저 및 RNase 억제제를 사용해야 합니다.에어로졸 오염은 찾기가 가장 어렵습니다.당신의 연구실이 다양한 핵산이 공중에 떠 있는 스모그와 같다고 상상해 보십시오.
NRT(역전사 없음), 역전사가 없는 대조군은 gDNA 잔기의 대조군인 음성 대조군으로서 역전사되지 않은 RNA이다.
유전자 발현 시 역전사 후 cDNA 양을 검출하여 RNA 양을 검출합니다.RNA를 정제할 때 gDNA 잔여물이 있으면 실제로 얻어지는 결과는 gDNA와 cDNA이기 때문에 실험 결과에 오차가 생긴다.cDNA뿐만 아니라 응집체 수준에서 gDNA는 RNA 추출 중에 완전히 제거되어야 합니다.
MIQE(2)—샘플 정보
소위 샘플 정보란 우리가 qPCR에 대한 기사를 출판할 때 샘플 정보를 명확하게 설명해야 한다는 것을 의미하며, 이는 기사의 필수 부분입니다.마찬가지로 샘플을 처리할 때 샘플의 유효성을 보장하기 위해 자체 작업도 규제해야 합니다.
샘플에 대한 설명은 결과일 뿐이며 전체 실험 중에 채취한 재료에 더욱 주의를 기울여야 합니다.
실험 재료의 선택
혈액 샘플 – 4시간 이내의 신선한 혈액을 선택하십시오.세포 샘플 – 활발한 성장 기간에 신선한 세포를 수집하도록 선택합니다.동물 조직 - 신선하고 활발하게 성장하는 조직을 선택합니다.식물 조직 – 신선하고 어린 조직을 선택하십시오.
이 몇 문장에 핵심 단어가 있다는 것을 눈치채셨을 것입니다: fresh .
위 샘플의 경우 시중에서 가장 저렴하고 안정적인 키트는 DNA와 RNA를 빠르고 쉽게 추출할 수 있는 Foregene의 키트입니다.
실험 재료의 보관
일반적으로 말하자면 조건이 허용되는 경우 샘플을 보관하지 않는 것이 좋습니다.하지만 샘플링 후 곧바로 실험을 할 수 없는 친구들도 많고, 샘플링을 위해 액체질소 탱크를 들고 현장에 나가야 하는 친구들도 있습니다.
이런 종류의 열심히 일하는 친구에게는 시약 소모품을 이해하지 못한다고 말할 수 있습니다.현재 많은 시약 소모품 회사에서 RNA 샘플을 실온에서 보관할 수 있는 시약을 생산하고 있으며 이를 선택하여 사용할 수 있습니다.기존의 저장 방식은 휴대가 간편한 소형 액체 질소 탱크를 이용한 액체 질소 저장 방식이다.샘플을 실험실로 다시 가져온 후 -80°C 냉장고에 보관하십시오.
RNA와 관련된 실험의 경우 6단어 원칙을 따라야 합니다.저온, 효소 없음,그리고빠른 .
저온의 개념은 이해하기 쉽습니다.효소가 없으면 RNase는 우리가 살고 있는 세계 어디에나 존재하므로(그렇지 않으면 HIV에 감염되었을 것입니다) 실험을 할 때 RNase를 피하는 방법은 매우 중요한 개념입니다.빠른,세상에 깨지지 않는 쿵푸는 없다 속도만 깨지지 않는다.
따라서 어떤 의미에서는 추출 시간이 짧을수록 더 좋은 키트입니다.왜포진의 키트는 속도를 잘 알고 있기 때문에 속도를 강조합니다.
추신: 일부 소녀들은 매우 신중하게 실험을 하지만 몇 년 동안 작업한 후 슬램덩크만큼 좋지는 않습니다.그들은 하나님이 불공평하다고 느끼며, 다른 사람들에 대해 불평하고, 생명을 찾고 있습니다.사실, 그녀는 그것을 이해하지 못했습니다.RNA를 잘 지키지 않았고, 슬램덩크 선수가 민첩했다.실험을 할 때 슬램덩크를 3회, 5회, 2구간으로 끝내겠다고 생각했는데 실험을 잘 해냈다.
메모: 느려지고 RNase 침입 가능성이 높아집니다.자신을 빠르게 훈련하는 방법?방법이 없습니다. 더 연습하십시오.
다른 실험과 다른 샘플에 대해 더 많은 문헌을 읽고 적절한 처리 방법을 선택하는 것이 여전히 필요합니다.샘플 수집 및 보관 과정에서 MIQE는 리뷰어가 논문의 신뢰성을 검토할 수 있도록 논문에 명확하게 작성해야 하며 기절한 젊은이들이 실험을 반복하는 것도 편리합니다.
생물학적 실험은 어렵지만 고급입니다.조심하지 않으면 세상을 뒤집을 수 있습니다.예를 들어, 사스를 생화학적 위기로 만들거나 잡종 쌀을 만들어 13억 명의 사람들을 구합니다.아래 사진은 화학 실험입니다. 그의 성기 같은 외모를 보는 것만으로도 연구에 대한 자부심을 알 수 있습니다.잊어버리세요, 그를 검게 만들지 마세요.
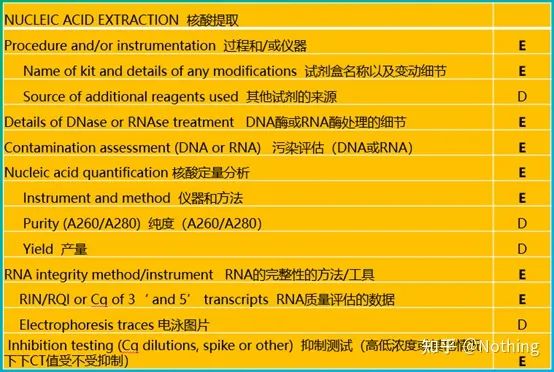
MIQE(3) – 핵산 추출.
핵산 추출은 큰 사건이며 모든 분자 생물학 실험은 핵산 추출에서 시작됩니다.먼저 MIQE의 핵산 추출에 대한 내용을 복사해 보겠습니다.
이 형태를 보면 표면에 머물 수 없습니다.형식은 교리입니다.최고의 학생이 되려면 그 이유를 물어야 합니다.이 테이블의 필수 내용은 다음과 같습니다. 추구RNA의 순도, 무결성, 일관성 및 추출량 .
의 첫 번째 부분은프로세스 또는 도구는 핵산 추출 단계입니다.자동 핵산 추출기를 사용하여 추출하는 경우(고급, 구매 문의 바랍니다) 기기의 모델명을 표시해야 합니다.
키트의 이름과
변경 내용에 어떤 키트를 사용했는지, 어떤 특수 시약을 추가했는지, 어떤 특수 작업을 했는지 등을 다른 사람이 쉽게 반복할 수 있도록 명확하게 설명해야 합니다.
어떤 사람들은 특수 샘플을 추출할 때 특수 시약을 추가하여 이것이 그들의 비밀 무기라고 생각하고 다른 사람들에게 말하지 않습니다.비밀을 유지하면서 기사를 빛나게 할 기회도 잃습니다.영리하지 마십시오. 과학 연구에서 시골 노인보다 더 정직해야합니다. 영리하고 싶다면 기사가 당신을 어리석게 만들 것입니다.
키트의 제품 번호를 기억해야 합니다.당신이 장비를 주문하고 기사를 쓸 때.키트에는 일반적으로 두 개의 번호가 있습니다. Cat - 카탈로그 번호(제품 번호, 품목 번호), Lot - 제품 로트 번호(제품이 어느 배치에서 왔는지 나타내는 데 사용됨).
또한 CAS 번호는 생화학 시약을 주문할 때 자주 사용되며 함께 대중화하겠습니다.CAS 번호는 American Chemical Society에서 각 신약에 부여하는 번호입니다.일반적으로 세 개의 숫자는 대시로 연결됩니다.Rushui의 CAS 번호: 7732-18-5.화학 물질에는 종종 여러 별칭이 있지만 CAS 번호는 고유합니다.약을 주문할 때 먼저 CAS 번호를 확인할 수 있습니다.
집에 더 가까이, 왜 우리는 이러한 것들을 명확하게 설명해야 합니까?사실 RNA 추출의 품질을 확인하는 것이기도 하다.기기와 키트를 사용하면 RNA 추출이 더욱 일관적으로 이루어집니다.일반 실험실의 추출 규모는 크지 않으며 키트로 얻을 수 있습니다.
DNase 또는 RNase 처리의 세부 사항
형광 정량 PCR의 중요한 이슈는 DNA 오염을 방지하는 것이며 오염이 있으면 실험하지 않는 것입니다.따라서 실험 과정에서 DNA가 완전하고 완벽하게 제거되었음을 입증하기 위해 DNA를 처리하는 데 사용한 과정을 명시하는 것이 필수적입니다.개략도에 의해 표현.
RNA와 DNA의 개략도
일반적으로 DNA를 제거하는 방법은 추출 후 RNA를 DNase로 처리하는 것이다.그러나 이들은 비교적 오래된 방법입니다.상업용 RNA 추출 키트는 추출 과정에서 DNase를 추가하지 않고 DNA를 제거할 수 있었습니다.예를 들어 Foregene의 일련의 키트 .
메모: RNA 추출 시 DNA를 제거하는 것은 매우 위험한 양날의 검으로, RNA 추출 작업 시간이 길어지고 RNA 분해의 위험이 높아집니다.기본적으로 RNA 수율과 순도 사이의 균형입니다.
또한, 실리카계 흡착 컬럼에 첨가되는 DNase의 양이 매우 적고, 그 효과를 얻기 위해서는 고품질의 DNase를 사용해야 한다.최적화되지 않은 DNase는 신속하고 완전하게 소화될 수 없습니다.이것은 상인의 기술 수준에 대한 테스트입니다.물론 DNase 없이도 DNA를 제거할 수 있다고 자랑하는 이상한 상인들이 더 많습니다.DNase 없이 DNA를 완전히 제거할 수 있다고 자랑하는 사람은 훌리건이라고 할 수 있습니다.DNA는 비교적 안정적인 이중나선 구조로, 말과 웃음만으로는 지워지지 않는다.
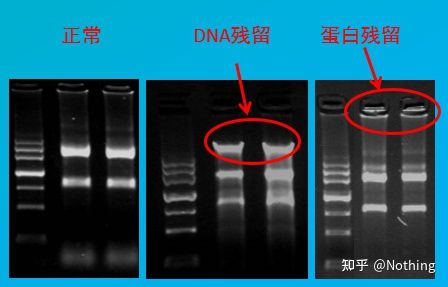
오염 평가
평가 방법: 전기영동 검출, 1% 아가로스, 6V/cm, 15분, 로딩 1-3 ul
핵산 정량 분석
일반적으로 UV 분광 광도계를 사용하여 측정합니다.먼저 OD260, OD280 및 OD230의 세 가지 값의 의미를 대중화하겠습니다.
·OD260nm: 핵산의 최고 흡수 피크의 흡수 파장으로 가장 잘 측정되는 값은 0.1~1.0 범위이다.그렇지 않은 경우 샘플을 희석하거나 농축하여 범위 내로 가져옵니다.
·OD280nm: 단백질 및 페놀성 물질의 최고 흡수 피크의 흡수 파장입니다.
·OD230nm: 탄수화물의 최고 흡수 피크의 흡수 파장이다.
다음으로 각 지표의 역할에 대해 알아보겠습니다.A260의 경우 핵산 수율을 측정하는 데 사용할 수 있습니다.OD260=1, dsDNA=50μg/ml, ssDNA=37μg/ml, RNA=40μg/ml일 때.
순도를 위해 우리는 일반적으로 볼 수 있는 비율인 OD260/280 및 OD260/230을 살펴봐야 합니다.
·순수 DNA: OD260/280은 대략 1.8입니다.1.9보다 크면 RNA 오염이 있음을 나타내고, 1.6 미만이면 단백질 및 페놀 오염이 있음을 나타냅니다.
·순수 RNA: 1.7
·OD260/230: DNA든 RNA든 기준값은 2.5입니다.2.0 미만이면 설탕, 소금 및 유기물의 오염이 있음을 나타냅니다.
RNA 무결성
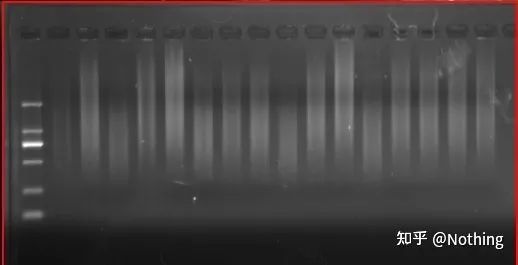
RNA의 무결성을 측정하는 것은 매우 중요합니다.일반적으로 28S와 18S RNA 사이의 밝기가 이중 관계인지 확인하기 위해 RNA denaturation gel 실험을 해야 합니다.세 번째 밴드 5S가 나타나면 무척추 동물을 제외하고 RNA가 분해되기 시작했음을 의미합니다.
RNA 품질 평가를 위한 데이터: 위의 테스트 외에도 RNA가 눈에 보이지 않게 분해되는지 여부를 감지할 수 있는 Experion 자동 전기 영동 시스템의 RQI 무결성 테스트와 같은 RNA 무결성 측면에서 좀 더 발전된 기기 테스트가 있습니다.
과학 연구에서 형광 정량적 PCR은 표적 유전자와 내부 참조 유전자 간의 비교입니다.따라서 RNA 시료 보존, RNA 추출 등의 과정에서 RNA의 무결성을 확보하는 것이 일차적인 목표입니다.
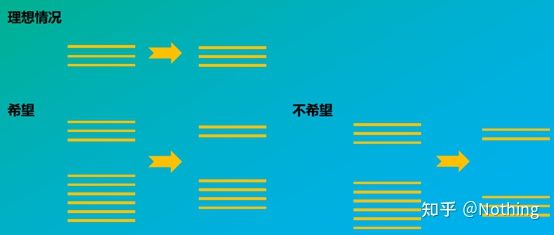
RNA의 무결성이 표적 유전자와 내부 참조 유전자 사이의 균형에 어떤 영향을 미치는지는 아래 그림에서 쉽게 이해할 수 있습니다.열화는 내부 참조 유전자의 불완전성이든 표적 유전자의 불완전성이든 관계없이 유전자 불완전성으로 이어질 것이며 데이터에 큰 영향을 미칩니다.
표적 유전자와 참조 유전자의 개략도는 사실이 아니어야 합니다.
억제 시험(고농도 또는 저농도 또는 기타 조건에서 CT 값이 억제되는지 여부)
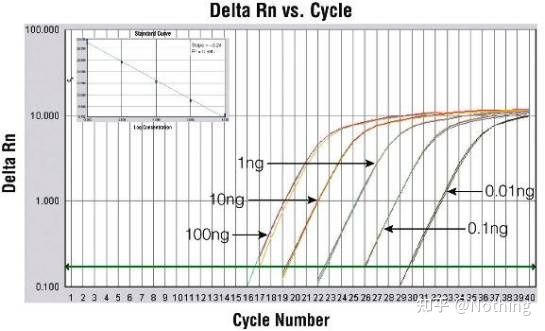
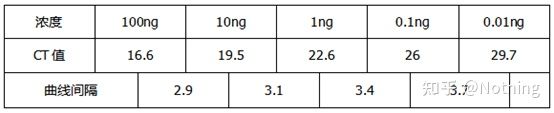
이 수치를 예로 들면 5개 곡선의 Ct 값은 다음과 같습니다.곡선간 CT 값의 분포가 고르지 않고 고농도와 저농도에서 Ct 값이 지연되는 현상이 PCR 억제의 경우이다.
Key point: RNA 추출 과정에서 오해를 버리고 올바른 것을 정립해야 합니다.
잘못된 생각은 RNA 추출은 얻은 RNA의 양이 많을수록 좋다는 생각으로 수율만을 추구한다는 것입니다.사실 우리가 정량화를 할 때 유전자의 수가 그다지 많지 않다면 RNA가 많이 필요하지 않습니다.추출한 RNA의 양은 충분합니다.
올바른 개념은 다음과 같습니다.RNA 추출은 순도, 무결성, 일관성을 추구해야 합니다..순도는 후속 역전사가 억제되지 않고 데이터가 DNA의 영향을 받지 않도록 보장할 수 있습니다.무결성은 대상 시퀀스와 내부 참조의 균형을 보장합니다.일관성은 안정적인 시료 로딩을 보장합니다.
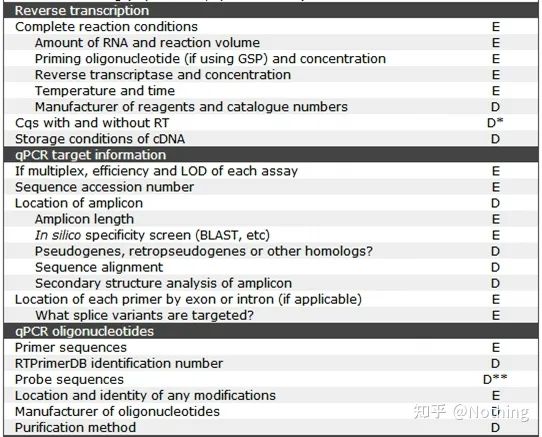
MIQE(4) – 역전사
오인: 더 많은 시료량을 추구합니다.
올바른 개념: 일관성(stability)을 추구하여 RNA의 양과 관계없이 역전사 효율이 일정하게 유지되어 cDNA의 차이가 mRNA의 차이를 진정으로 반영할 수 있음을 보장합니다.
도식 다이어그램으로 이 프로세스를 설명합니다.
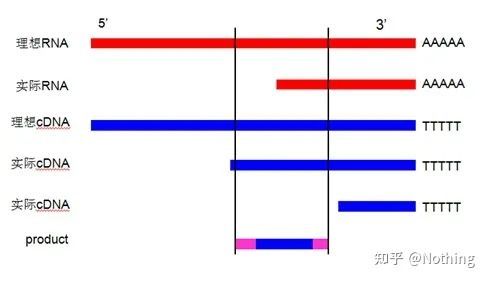
역전사 효율의 개략도, 사실이 아님
먼저 역전사 과정과 PCR 과정의 차이점을 이해해야 합니다.PCR은 여러 번의 가열 및 어닐링 과정을 거치며 대상 조각은 기하급수적으로 증가합니다.역전사는 이 과정이 없지만 역전사는 실제로 일대일이라고 상상할 수 있습니다. 복제 과정에서 많은 RNA 조각이
많은 cDNA 정보를 얻을 수 있기 때문에 크고 작은 조각들이 역전사되어 하나의 조각에 집중하는 것이 불가능하기 때문에 지금쯤은 이해가 되어야 할 것입니다.그리고 RNA의 양이 상대적으로 적기 때문에 증폭 효과가 있는 PCR과 달리 얻어지는 cDNA의 양도 상대적으로 적기 때문에 기본적으로 검출이 불가능하다.
cDNA 전기영동 결과
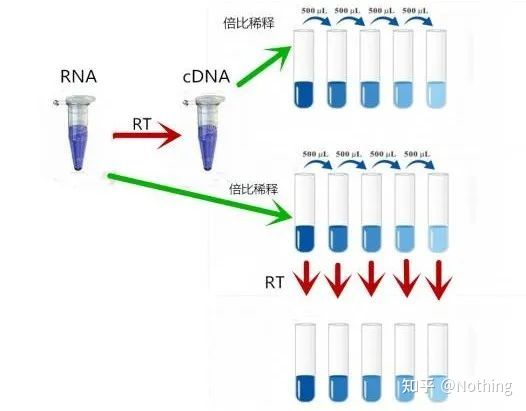
둘째, 이상적으로 역전사는 일대일로 수행되지만 어떤 회사의 역전사 효소도 이러한 효과를 얻을 수 없습니다.기본적으로 대부분의 역전사 효소의 효율성은 30-50% 사이를 방황합니다.그렇다면 우리는 오히려 상대적으로 안정적인 역전사 효율을 가지게 되는데, 이것이 우리가 그림에서 보고자 하는 것입니다: 3개의 RNA는 2개의 cDNA를 얻고, 6개의 RNA는 4개의 cDNA를 얻으므로 아무리 많은 샘플이 로드되더라도 역전사 효율은 상대적으로 안정적입니다.역전사 효율이 불안정하고 고농도가 억제되는 상황을 보고 싶지 않습니다.
그렇다면 역전사 효율이 안정적인지 확인하는 방법은 무엇일까요?방법은 매우 간단하여 비교 테스트만 하면 됩니다. 하나는 RNA를 2배로 희석한 후 cDNA로 역전사하는 것이고, 다른 하나는 cDNA로 역전사한 후 2배로 희석하여 qPCR을 하여 구한 기울기가 일치하는지 확인하는 것입니다.최고의 학생으로서 당신은 몇 초 안에 그것을 이해해야 합니다.아래 그림과 같이:
역전사의 효율이 안정적인지 시험하기 위한 RNA 및 cDNA의 희석
역전사 효소 및 키트
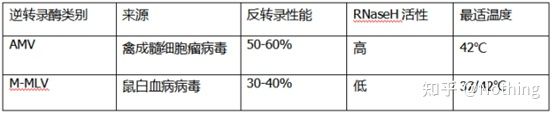
어떻게 완벽한 형광 정량적 PCR이 우수한 역전사 효소 및 키트를 가질 수 있습니까?역전사 효소는 소스에 따라 크게 AMV 또는M-MLV, 그들의 성능은 표에 표시된 것과 동일합니다.
RNase H 활동
RNase H는 Ribonuclease H이고 중국 이름은 ribonuclease H로 DNA-RNA 하이브리드 사슬에서 RNA를 특이적으로 가수분해할 수 있는 endoribonuclease입니다.RNase H는 단일 가닥 또는 이중 가닥 DNA 또는 RNA의 포스포디에스테르 결합을 가수분해할 수 없습니다. 즉, 단일 가닥 또는 이중 가닥 DNA 또는 RNA를 분해할 수 없습니다.cDNA의 두 번째 가닥 합성에 일반적으로 사용됩니다.
이상한 일입니다.우리는 역전사 효소가 RNase H 활성을 가지고 있다고 말하지만, 역전사 효소가 RNase H를 포함하는 것은 아니며, 아마도 역전사 효소에서 특정 그룹의 형태 때문에 RNase H를 역전사 효소에서 분리하는 것이 불가능할 수 있습니다. 이 활성은 역전사 효소에 의해 발생합니다.
따라서 AMV의 역전사 효율이 높더라도 AMV의 RNase H 활성은 cDNA의 수율을 감소시킵니다.물론 시약 제조사들은 cDNA의 수율을 높이기 위해 역전사 효소에서 RNase H 활성을 최대한 제거하기 위해 지속적으로 제품을 최적화하고 있습니다.
어닐링 온도
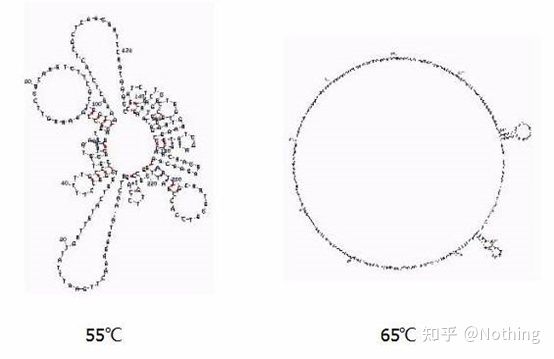
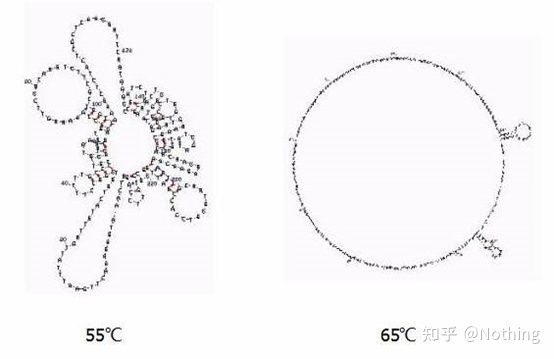
다른 온도에서 RNA의 2차 구조
다른 온도에서 RNA의 2차 구조에 대해서는 위의 그림을 참조하고 mFold 온라인 도구를 사용하여 특정 온도 및 염 농도 조건에서 대상 조각의 2차 구조를 결정하십시오.55°C에서 RNA의 2차 구조는 여전히 매우 복잡하고 역전사효소가 작동할 수 없으며 65°C까지 2차 구조가 완전히 분해될 수 없지만 AMV 및 M-MLV의 최적 온도는 이 온도보다 훨씬 낮습니다.
무엇을 해야 합니까?2차 구조는 주형 자체의 상보적인 쌍으로, 이는 프라이머와 역전사 효소와 주형 간의 강력한 경쟁으로 이어져 낮은 E 및 열악한 반복성과 같은 일련의 문제를 초래합니다.
무엇을 해야 합니까?어닐링 온도를 가능한 한 많이 높이십시오.
많은 시약 제조업체는 유전 공학을 통해 역전사 효소를 개선하고 있습니다.일부는 Jifan 및 Aidelai와 같이 반응 온도를 높이고 일부는 RNase H 효소의 활성 그룹을 제거하여 효소와 RNA 템플릿 간의 친화력을 향상시킵니다.높은 친화력은 2차 구조를 경쟁적으로 짜내고 원활하게 읽을 수 있으며 역전사의 효율성도 크게 향상시킵니다.
Key point: 역전사 효율(효소는 효율적일 뿐만 아니라 안정적이어야 함)의 일관성을 추구하는 것이 더 중요하며, 특히 대규모 형광 정량적 PCR이 아니면 전혀 불가능합니다.다중 cDNA.
다양한 제조업체들도 일관성을 추구하기 위해 약간의 노력을 기울였습니다.예를 들어, 대부분의 회사는 이제 판매용 표준 키트로 역전사를 패키징했으며 이는 좋은 선택입니다.
예를 들어 Foregene의 RT Easy 시리즈 키트는 다음과 같습니다.
RT Easy I(First strand cDNA 합성용 Master premix )
MIQE(5) – 표적 유전자 정보
위의 그림은 설명합니다
1. 이 유전자가 반복 실험에 효과적인지 여부는 일반적으로 반복 실험을 통해 확인할 수 있습니다.
2. 유전자 ID.
3. 유전자 길이, 표적 유전자의 총 길이는 확실히 문제가 되지 않습니다.프라이머를 디자인할 때 더 나은 증폭 효율을 보장하기 위해 amplicon의 길이가 80-200bp 사이인지 확인하십시오.
4. Sequence Blast 비교 정보, 비특이적 증폭을 방지하기 위해 유전자 은행에서 표적 유전자를 비교해야 합니다.
5. pseudogenes의 존재.pseudogene은 정상 유전자와 유사하지만 정상적인 기능을 상실한 DNA 서열입니다.진핵생물의 다유전자 계열에 종종 존재합니다.일반적으로 ψ로 표시됩니다.그것은 코딩 유전자 서열과 매우 유사한 게놈의 비기능적 게놈 DNA 사본입니다., 일반적으로 전사되지 않으며 명확한 생리학적 의미가 없습니다.
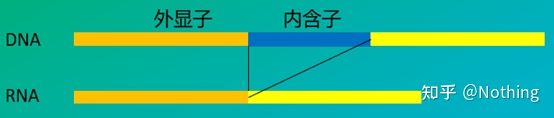
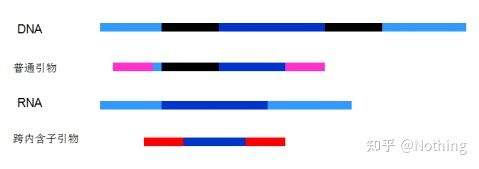
6. 엑손 및 인트론에 대한 프라이머의 위치.초기에 DNA 오염 문제를 해결할 때 프라이머, 엑손, 인트론의 위치에 주의를 기울이는 경우가 많았고 일반적으로 DNA 증폭을 피하기 위해 인트론을 가로지르는 프라이머 설계를 고려했습니다.아래 그림을 참조하십시오. 검은색은 인트론을 나타내고 다양한 파란색은 엑손을 나타내고 분홍색은 일반 프라이머를 나타내고 밝은 빨간색은 인트론 스패닝 프라이머를 나타냅니다.
도식적, 사실이 아님
이것은 완벽한 계획처럼 보이지만 사실 대부분의 경우 트랜스 인트론 프라이머는 상상만큼 마법적이지 않으며 비특이적 증폭을 일으키기도 합니다.따라서 DNA 오염을 방지하는 가장 좋은 방법은 DNA를 완전히 제거하는 것입니다.
7. 형태 예측.이 예를 다시 사용하여 mFold 온라인 도구를 사용하여 특정 온도 및 염 농도에서 대상 조각의 2차 구조를 결정합니다.
다른 온도에서 RNA의 2차 구조
2차 구조는 주형 자체의 상보적 짝짓기로, 이는 프라이머와 주형 쌍 사이의 강한 경쟁으로 이어질 것이며, 프라이머 결합의 기회가 적어져 낮은 E 및 불량한 반복성과 같은 일련의 문제가 발생합니다.소프트웨어 예측을 통해 2차 구조 문제가 없다면 좋을 것입니다.있는 경우 후속 기사에서 이 문제를 해결하는 방법에 대해 구체적으로 설명합니다.
MIQE(6) - qPCR 올리고뉴클레오티드
형광 정량 PCR의 경우 매일 가장 먼저 고민하는 것이 RNA 추출이고 두 번째로 프라이머 디자인이 될 수 있습니다.
우선 MIQE 체크리스트에 따라 프라이머 디자인에 대한 규칙을 여전히 확인합니다.쓰레기들이 웃을 정도로 간단하고 한 문장으로 끝낼 수 있습니다. 프라이머 프로브의 순서와 위치 및 수정 방법을 찾으십시오.Primer 정제 방법의 경우 현재 Primer 합성이 매우 저렴하고 qPCR은 PAGE 이상의 정제 방법에 적합하며 합성 장비의 정보는 중요하지 않습니다.많은 사람들이 수십년 동안 프라이머를 해왔고 신디사이저가 ABI3900이라는 것을 모릅니다.
프라이머 디자인의 원칙에 관해서는 암기할 필요가 없습니다. 대부분의 프라이머 디자인 소프트웨어나 온라인 도구가 이러한 문제를 해결할 수 있고(온라인 도구 primer3.ut.ee/ 권장), 프라이머 디자인의 99.999%는 수동으로 수행되지 않습니다. 보세요, 저자는 때때로 하루에 수백 개의 프라이머를 디자인합니다. 하나씩 읽으면 사시가 될 것입니다.
프라이머를 디자인한 후 다음 사항을 확인하십시오.
1. 3' 말단에 가까운 프라이머 설계: cDNA first-strand 합성을 위해 oligo dT 프라이머를 사용하는 경우, 역전사 효율 및 RNA 무결성을 고려하여 설계된 프라이머는 증폭 효율을 향상시키기 위해 3' 말단에 가깝게 설계해야 합니다.그림을 사용하여 다음과 같이 설명하십시오(이해할 방법이 없음).
왜 프라이머가 3' 말단에 가깝게 설계되어야 하는지, 사실이 아니어야 합니다.
2. TM 값: Tm 값은 55-65°C(60°C에서 엑소뉴클레아제 활성이 가장 높기 때문에)이고 GC 함량은 40%-60%입니다.
3. BLAST: 게놈의 비특이적 증폭을 피하기 위해 Blast를 이용하여 보완 검증을 해야 합니다.
MIQE(7) - qPCR 프로세스
1. qPCR 키트
MIQE의 요구 사항에 따라 PCR 반응 시스템의 구성, 어떤 키트를 사용하는지, 제조업체는 누구인지, 반응 시스템의 크기는 어느 정도인지, 염료 방법 또는 프로브 방법을 사용하는지 여부, PCR 프로그램 설정을 포함하여 완전한 반응 조건을 기사에 명확하게 설명해야 합니다.베테랑 드라이버는 키트를 선택하는 한 기본적으로 위의 정보가 결정된다는 것을 확실히 알게 될 것입니다.
현재 형광 정량 PCR 키트의 제조 및 생산은 매우 성숙한 기술입니다.극도로 나쁜 제조업체를 선택하지 않는 한 문제의 가능성은 높지 않지만 여전히 몇 가지 사항을 공유하고 싶습니다.
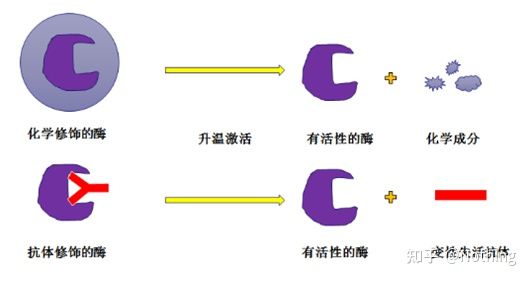
핫스타트 Taq 효소:PCR에서 가장 중요한 부분은 hot-start Taq 효소입니다.시중에서 판매되는 핫스타트 효소는 일반적으로 화학적으로 변형된 핫스타트 효소(파라핀 포매로 상상할 수 있음)와 항체 변형(항원-항체 결합)을 위한 핫스타트 효소인 두 가지 유형으로 나뉩니다.화학적 변형은 핫 스타트 효소의 초기 방법입니다.특정 온도에 도달하면 효소가 활성을 방출합니다.항체 변형 핫스타트 효소는 생물학적 방법을 사용하여 효소의 활성을 차단합니다.특정 온도에 도달하면 항체가 변성되어 단백질로 불활성화되고 효소 활성이 작용합니다.
그러나 이것의 용도는 무엇입니까?이 경우 화학적으로 변형된 효소보다 항체로 변형된 효소의 방출 활성이 빠르기 때문에 민감도 측면에서 항체로 변형된 효소가 약간의 이점이 있으므로 기본적으로 시중에 나와 있는 키트에는 화학적으로 변형된 효소가 없습니다.그렇다면 이 제조업체의 기술은 여전히 밀레니엄 시대에 머물러 있는 것입니다.
마그네슘 이온 농도:마그네슘 이온 농도는 PCR 반응에서 매우 중요합니다.적절한 마그네슘 이온 농도는 Taq 효소 활성의 방출을 촉진할 수 있습니다.농도가 너무 낮으면 효소 활성이 크게 감소합니다.농도가 너무 높으면 효소 촉매 비특이적 증폭이 향상됩니다.마그네슘 이온의 농도는 또한 프라이머의 어닐링, 템플릿 및 PCR 산물의 녹는 온도에 영향을 미치므로 증폭된 조각의 수율에 영향을 미칩니다.마그네슘 이온의 농도는 일반적으로 25mM로 조절된다.물론 좋은 키트를 위해서는 마그네슘 이온의 농도가 잘 조절되어야 합니다.일부 상인은 시약에 마그네슘 이온 킬레이트제를 추가하여 마그네슘 이온 농도의 자동 조정 효과를 얻을 수 있습니다.
형광 염료 농도:우리가 일반적으로 사용하는 SYBR Green인 형광염료는 주로 이중가닥 DNA의 마이너 그루브에 결합하여 형광을 발생시키는데, 이는 염료가 이중가닥 DNA에 결합하는 것이 비특이적이기 때문입니다.
추신: 빛에 민감한 특성으로 인해 시중의 제품은 일반적으로 갈색 불투명 원심분리기 튜브에 포장되어 있습니다(아래 그림 참조).그러나 이것은 문제가 발생합니다.샘플링 시 액체가 빨려 들어가는지 확인하기 어렵습니다.그런 점에서 Qingke는 참으로 가장 사용자 친화적이며(아래 그림 참조) 투명 튜브가 불투명한 틴백에 포장되어 있습니다.그런 다음 빛을 피하고 샘플링하는 편의성을 고려하여 주석 백에 넣습니다.올바른 제품 번호를 선택해야 합니다.TSE204는 잔디를 심고 싶어지는 초 가성비 존재입니다.
형광 염료의 농도 또한 매우 중요합니다.농도가 너무 낮으면 나중에 증폭 곡선이 올라가지 않고 완벽하지 않습니다.농도가 너무 높으면 노이즈 간섭이 발생합니다.형광 정량적 PCR은 주로 CT 값에 의존하기 때문에 형광염료의 농도를 적절하게 조절하지 않으면 높은 점보다 낮은 점이 더 좋다.물론 적절한 염료 농도가 가장 좋습니다.
록스: ROX 염료를 사용하여 well 간 형광 신호 오류를 보정합니다.일부 기기 제조업체는 교정이 필요하지만 다른 제조업체는 필요하지 않습니다.예를 들어, Thermo Fisher Scientific의 Real Time PCR 증폭 기기를 사용하려면 일반적으로 7300, 7500, 7500Fast, StepOnePlus 등을 포함하는 보정이 필요합니다. 일반 키트 지침에 설명되어 있습니다.
포진의 qPCR Mix는 ROX 염료도 포함되어 있어 다양한 모델에 사용하기 편리합니다.
약한 수소 결합 처리: 약한 수소결합의 처리는 비교적 기술적인 문제이다.많은 키트의 설명서를 읽은 사람은 없지만 이 주제에 대해 언급한 사람은 없습니다.사실, 그것은 매우 중요합니다.염기의 조합은 주로 수소 결합의 강도에 따라 달라집니다.강한 수소 결합은 정상적인 증폭이고 약한 수소 결합은 비특이적 증폭을 초래합니다.약한 수소결합을 잘 제거하지 못하면 비특이적 증폭을 피할 수 없다.저자의 범위 내에서 소수의 회사만이 이 문제를 인지했습니다.키트를 구매할 때 선택하려는 키트에 대해 이와 관련하여 솔루션을 고려했는지 여부를 참조할 수 있습니다.
반응량: 20-50ul 시스템이 더 많이 사용되며 용량이 작을수록 오류가 발생할 수 있습니다.일반적으로 키트 지침은 PCR 반응 볼륨의 사용을 권장합니다.똑똑하지 말고 더 작은 볼륨을 사용하여 비용을 절약하십시오.의 목표.가맹점에서 추천하는 볼륨은 실제로 테스트를 거쳤으며 소량으로 인한 오류 문제를 해결할 수 없습니다.
2. 튜브플레이트의 제조사 및 품번
형광 정량 PCR의 원리는 누구나 알고 있습니다.형광 수집은 주로 PCR 튜브 캡을 통해 수행됩니다.PCR 소모품을 선택할 때 두 가지 사항에 주의하십시오. 좋은 빛 투과율과 장비에 적합합니다.일반적으로 주류 브랜드의 보드와 튜브는 괜찮지만 적응 측면에서 신중하게 선택해야 합니다. 그렇지 않으면 악기를 사용할 수 없습니다.
4. 최고 수준의 지식
MIQE(8) - qPCR 검증
이것이 qPCR의 최우선 과제입니다!너무 많은 영웅들이 여기 모래에 빠졌습니다.물론 운이 좋아서 연구한 유전자가 단순해서 바람을 따라 얼음 동굴을 떠다녔을 수도 있다.qPCR의 검증 정보는 데이터의 신뢰성을 테스트하기 위한 것입니다.필요한 확인 정보는 다음과 같습니다.
1.특이성 시험
표적 유전자 증폭의 특이성은 전기영동 사진이 단일 밴드인지 여부를 확인하여 테스트합니다.시퀀싱 검증;피크 맵이 단일인지 확인하기 위한 용융 곡선;효소 분해 확인 및 기타 방법.
여기서 우리는 t에 초점을 맞춥니다.용융곡선법을 이용한 비특이적 증폭 분석.일반적으로 프라이머를 디자인할 때 product fragment의 크기는 80-200bp 범위여야 하며, 이는 PCR product의 녹는 온도를 80-85 °C 범위로 만듭니다.따라서 기타 피크가 있는 경우 다른 비특이적 증폭 산물이 있어야 합니다.피크가 80°C 미만에서 나타나면 일반적으로 프라이머 이합체로 간주됩니다.피크가 85°C 이상에서 나타나면 일반적으로 DNA 오염 또는 큰 조각의 비특이적 증폭으로 간주됩니다.
참고: 때때로 80°C에서 단일 피크만 있습니다.이때 이 개념을 지켜야 합니다.증폭 결과는 모두 프라이머 다이머일 가능성이 높습니다.
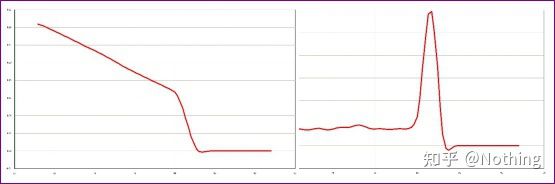
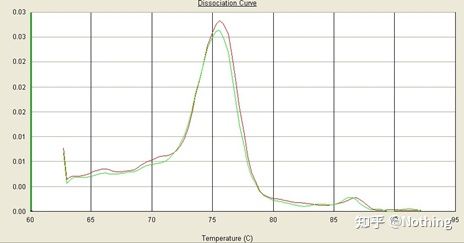
일반 용융 곡선(비특이적 증폭이 없는 단일 피크)
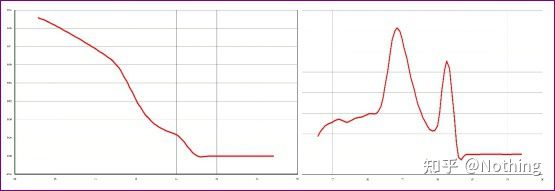
문제가 있는 용융 곡선(가짜 피크의 비특정 증폭)
【사례 분석】
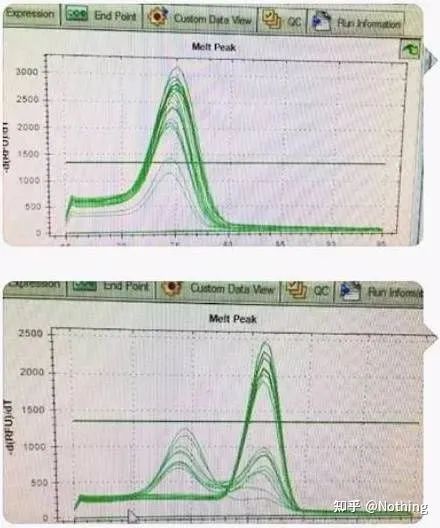
메인피크는 있으나 프라이머다이머가 심함
아래 그림의 단일 피크 융해곡선은 완벽한 실험이라고 착각하기 쉬우나 결과는 완전히 틀립니다.이때 녹는 온도를 살펴봐야 합니다.피크 온도는 80°C 미만이며 완전히 프라이머-다이머입니다.
표적 조각 없음, 모든 프라이머 이합체
여기서 동생은 멈출 수 없습니다.아래 사진은 쓰레기가 보내준 휴대폰으로 찍은 사진이다.그가 사용한 시약은 모두 업계에서 일반적으로 사용되는 브랜드입니다.그는 한 T-접두사 브랜드에서 다른 T-접두사 브랜드로 변경했습니다.나는 당신이 이미 그것을 추측했다고 생각합니다.쓰레기는 저에게 외쳤습니다. “첫 번째 사진에 사용 된 시약이 너무 좋고 피크가 단일입니다.나중에 추천해주신 시약을 사용하고 나면 두 번째 사진처럼 봉우리가 섞인 상태가 됩니다.당신은 나를 비참하게 만들었습니다.“
두 그래프를 분리합니다.언뜻 보기에 하나는 단일 봉우리이고 다른 하나는 이중 봉우리입니다.말도 안돼, 단일 피크는 물론 괜찮습니다.사실인가요?
Dou E보다 더 나쁜 것은 아래 사진에 두 장의 사진을 넣으면 즉시 이해할 것입니다.사실, 우리는 이런 종류의 그림에 쉽게 마비됩니다.신중한 분석 후 우리는 다음을 발견했습니다. 첫 번째 그림의 피크는 75°C에서 완전히 프라이머 이합체입니다.두 번째 그림의 피크는 75°C 및 82°C에서 나타납니다. 적어도 제품이 나타납니다.
학생들의 피드백 사진
따라서 근본적인 문제는 시약의 문제가 아니라 프라이머 디자인의 문제입니다.동시에 일부 대형 브랜드는 철 품질이 아님을 증명하고 내 형제가 전에 말한 것을 증명합니다. 당신의 기사를 뒷받침하는 것은 시약 브랜드가 아닙니다.시약 브랜드를 지탱한 것은 당신의 글입니다.쓰레기가 시약을 바꾸지 않으면 저널에 잘못된 데이터가 전송되어 비극이 벌어질 것이라고 상상해 보십시오.
2. 블랭크 컨트롤의 Ct 값
빈 컨트롤에 Ct 값이 있으면 설명하지 마십시오. 오염이 아닙니까?그러나 Ct 값이 있는 빈 컨트롤을 이해해야 합니다.NTC라면 시약 오염 등 외부 DNA가 있다는 뜻이다.NRT라면 추출된 RNA에 DNA 오염이 있다는 뜻이다.
3. 표준 곡선
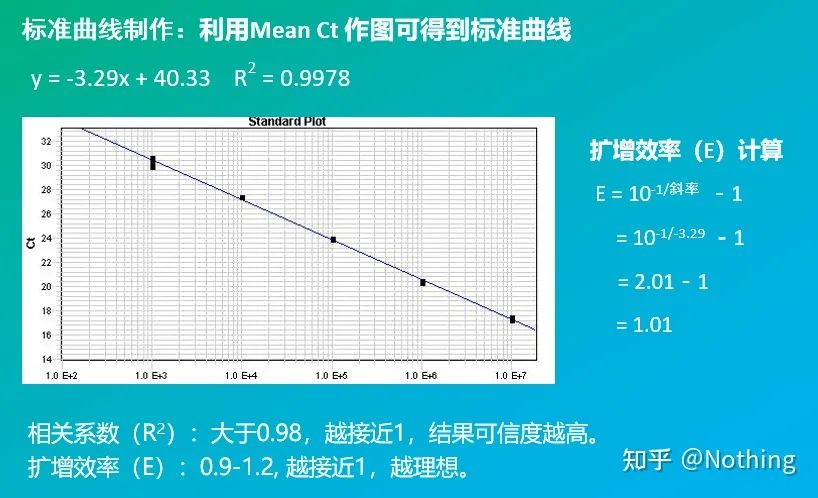
기울기 및 계산 공식을 포함하여 공식을 통해 PCR 효율을 계산할 수 있습니다.완벽한 실험을 위해서는 표준 곡선의 기울기가 3.32에 접근하고 R²가 0.9999에 접근해야 합니다.
4. 선형 동적 범위
반응의 동적 범위는 선형입니다.표준 곡선을 생성하는 데 사용되는 템플릿에 따르면 동적 범위에는 최소 5개의 농도 구배가 포함되어야 하며 높은 농도 구배와 낮은 농도 구배에서 Ct 값의 변화에 주의해야 합니다.
5. 감지 정확도
qPCR 결과의 변화, 즉 반복성 불량, 즉 정밀도 불량은 온도, 농도, 작동 등 여러 요인에 의해 발생합니다.qPCR 정밀도는 일반적으로 복제 수가 감소함에 따라 제어하기 어려워집니다.이상적으로는 실험 내 변이, 이 기술적 변이는 생물학적 변이와 구별되어야 하며 생물학적 복제는 그룹 또는 치료 간 qPCR 결과의 통계적 차이를 직접 해결할 수 있습니다.특히 진단 분석의 경우 현장 및 작업자 전체에서 최고의 분석 간 정밀도(반복성)를 보고해야 합니다.
6. 검출 효율 및 LOD(다중 qPCR에서)
LOD는 검출된 양성 샘플의 95% 중 가장 낮은 농도입니다.즉, 표적 유전자 복제 세트에 포함된 LOD의 농도는 실패한 반응의 5%를 초과해서는 안 됩니다.다중 qPCR 분석을 수행할 때, 특히 점 돌연변이 또는 다형성의 동시 검출을 위해 다중 qPCR은 동일한 튜브에서 다중 표적 단편의 정확도가 손상되지 않는다는 증거를 제공해야 합니다. 다중 검출 및 단일 튜브 검출 효율 및 LOD는 동일해야 합니다.특히 고농도의 표적 유전자와 저농도의 표적 유전자를 동시에 증폭시키는 경우에는 이러한 문제에 주의를 기울여야 한다.
문제 및 솔루션일반적으로 qPCR 디버깅에서 자주 발생하는 문제는 다음 측면에 중점을 둡니다.
·비특이적 증폭
·프라이머 농도 선택의 어려움 및 프라이머-다이머의 트러블
· 어닐링 온도가 정확하지 않습니다.
·2차 구조가 증폭 효율에 영향을 미침
비특이적 증폭
비특이적 증폭가 발생하는 경우에는 일반적으로 프라이머 디자인이 적합하지 않은 경우를 고려하는데 급하게 프라이머를 교체할 것이 아니라면 다음과 같은 방법을 먼저 시도해 볼 수 있습니다(원리도 첨부).
·어닐링 온도를 높이십시오 – 약한 수소 결합을 유지할 수 없도록 만드십시오.
·어닐링 및 연신 시간 단축 - 약한 수소 결합의 기회를 줄입니다.
·프라이머 농도 감소 – 중복 프라이머 및 비표적 영역의 결합 가능성을 줄입니다.
낮은 증폭 효율
비특이적 증폭의 반대 상황 – 낮은 증폭 효율 및 낮은 증폭 효율을 처리하기 위한 조치는 정반대입니다.
·어닐링 및 연신 시간 연장;
·3단계 PCR로 변경하고 어닐링 온도를 낮추십시오.
·프라이머 농도를 높이십시오.
Ps: 90년대에 태어난 많은 대학원생들은 실험을 디버깅하는 방법을 연구하기를 꺼려하고 키트가 문제를 완전히 해결할 수 있기를 바랍니다 (졸업 후 시약 회사에 가서 연구 개발을하려는 경우).이 문제를 쉽게 해결하기 위해 바보들은 여전히 시약 회사의 소개를 읽고 약한 수소 결합을 흡수하는 요인이 있는지 확인해야 합니다.
Primer 농도 선택의 어려움 및 primer-dimer 문제
방법 1: 일반적으로 qPCR을 위한 키트 설명서에는 권장 시스템과 권장 프라이머 농도가 나와 있습니다.
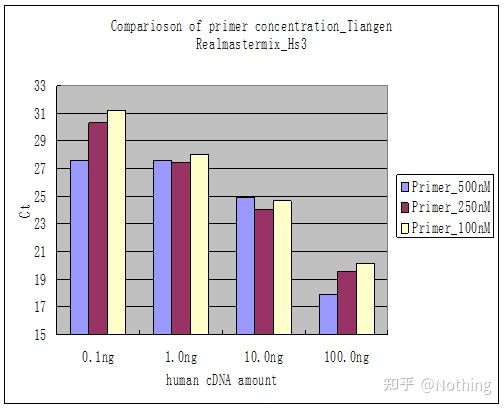
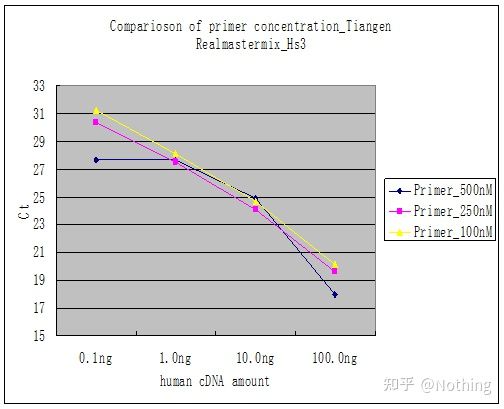
방법 2: 프라이머 농도 기울기를 설정하여 디버깅합니다.아래 그림은 설명을 위해 회사에서 훔친 것입니다.아래 그림은 3개의 프라이머 농도 구배(100nM, 250nM, 500nM)와 4개의 주형 농도 구배(0.1ng, 1ng, 10ng, 100ng)로 만든 형광 정량 결과를 보여줍니다.실험 결과의 Ct 값은 다음과 같이 플롯됩니다.
프라이머 농도 선택 다음과 같이 각 프라이머 농도를 한 줄로 연결합니다.
프라이머 농도의 선택은 명백하고, 프라이머 농도 100nM과 250nM의 선형 관계가 더 좋고, 프라이머 농도 500nM의 선형 관계는 상대적으로 좋지 않습니다.100nM과 250nM에서 250nM의 Ct 값은 상대적으로 작기 때문에 최적의 프라이머 농도는 250nM입니다.일반적으로 용융 곡선에서 심각한 프라이머-다이머를 볼 수 있습니다.설계된 프라이머가 프라이머-다이머를 피할 수 없다면?
방법 3: 프라이머 양을 줄이고 어닐링 온도를 높인다(설명 필요 없음).
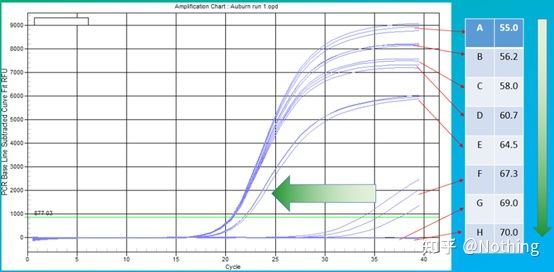
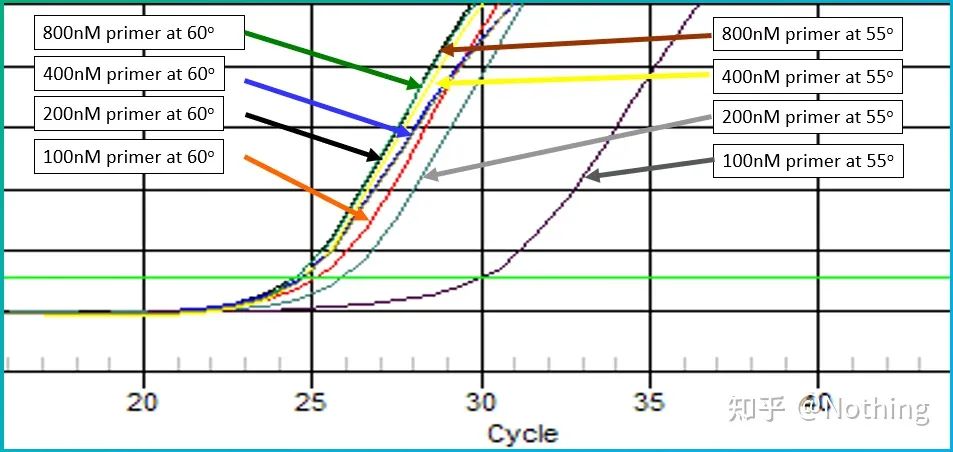
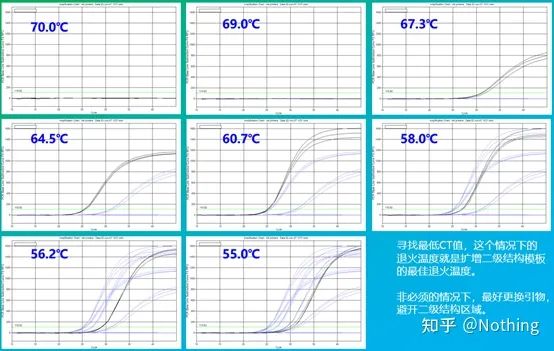
어닐링 온도의 실험값은 60°C입니다.확실하지 않은 경우 더 적합한 어닐링 온도를 선택하는 방법은 무엇입니까?대답은 프라이머 농도의 선택과 동일합니다 –그래디언트 테스트.문제를 설명하기 위해 Bio-rad 회사에서 사진을 찍으십시오.특정 대상 단편의 증폭을 위해 8개의 온도 구배를 설정하고 각각 3회 반복하며 얻은 증폭 곡선은 다음과 같습니다.
어닐링 온도 선택:
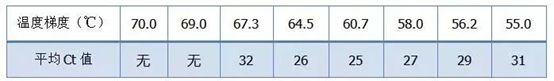
·70°C, 69°C - 기본적으로 프라이머의 결합이 불가능하여 증폭이 되지 않는다.
·67.3°C – 초반에 증폭량이 적고 Ct 값이 상대적으로 크다.
·64.5°C——Ct 값이 감소합니다.
·60.7°C, 58.0°C, 56.2°C, 55.0°C에서 Ct 값은 기본적으로 안정적인 경향을 보였으나 최종 형광값은 달랐다.
선택하는 방법?원리: 첫 번째 원리는 더 높은 Ct 값입니다.동일한 Ct 값의 경우 이합체화 및 비특이적 증폭을 피하기 위해 더 높은 어닐링 온도를 선택합니다.55°C에서 더 높은 형광 값을 나타내지만, 이합체 또는 비특이적 증폭이 있을 수 있습니다.
그러나 당신이 당신만큼 똑똑하다면 분명히 생각할 것입니다. 논리적으로 말하면 PCR 반응이 매우 특이적인 경우 프라이머 농도가 최소 요구 사항을 초과하는 한 높은 점과 낮은 점은 형광 염료 및 dNTP와 마찬가지로 영향을 미치지 않아야 합니다.실제로 어닐링 온도가 적절하게 최적화되는 한 프라이머 농도가 Ct 값에 미치는 영향은 자연스럽게 최소화됩니다.
어닐링 온도가 적절하게 최적화되고 CT에 대한 프라이머 농도의 영향이 최소화됩니다.
증폭 효율에 영향을 미치는 2차 구조
문제를 설명하기 위해 Bio-rad에서 사진을 가져옵니다.또한 2차 구조를 가진 유전자를 증폭하기 위해 온도 구배를 설계합니다.
2차 구조가 나타난다
온도 구배가 감소함에 따라 생성물이 나타나기 시작하고 Ct 값이 앞으로 이동하여 60.7°C에서 최소값에 도달한 다음 온도 구배가 감소함에 따라 Ct 값이 커지는 것을 볼 수 있습니다.반대로 온도가 높아지면 2차 구조가 열리고 증폭 효율이 높아집니다.특정 온도에 도달한 후 온도를 높이면 증폭 효율이 향상되지 않습니다.이때 프라이머가 안정적으로 결합될 수 없기 때문입니다.그러므로,Ct 값이 가장 낮은 온도를 찾습니다., 2차 구조 템플릿을 증폭하기 위한 최적의 온도입니다!물론 똑똑한 바보들은 필요하지 않다면 프라이머를 변경하고 2차 구조 영역을 피하는 것이 최선이라는 것을 알아야 합니다.
5. 적용 수준
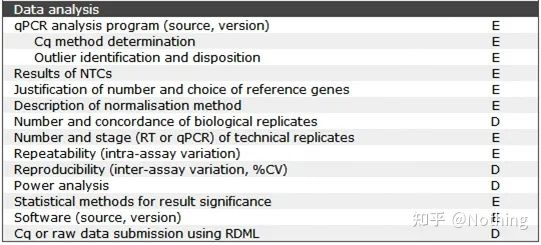
MIQE - 데이터 분석
데이터 분석은 주로 형광 정량 PCR 장비에 의해 제공됩니다.앞선 글에서 실험의 설계에서 설명한 blank control 등 많은 데이터 분석 작업이 이루어졌다.내부 참조 유전자, 반복 번호 등이 명확해졌습니다., 여기서는 주로 qPCR의 적용에 대해 설명합니다.
qPCR이 널리 사용되며 실험 검증 및 핵산 진단이 가장 일반적으로 사용되는 시나리오입니다.
절대 정량화
Log(초기 농도)는 사이클 수와 선형 관계가 있습니다.알려진 초기 복제 수를 가진 표준에서 표준 곡선을 그릴 수 있습니다. 즉, 증폭 반응의 선형 관계를 얻을 수 있습니다.샘플의 Ct 값에 따라 샘플의 농도를 계산할 수 있습니다.포함할 템플릿의 양입니다.
절대 정량적 계산 방법
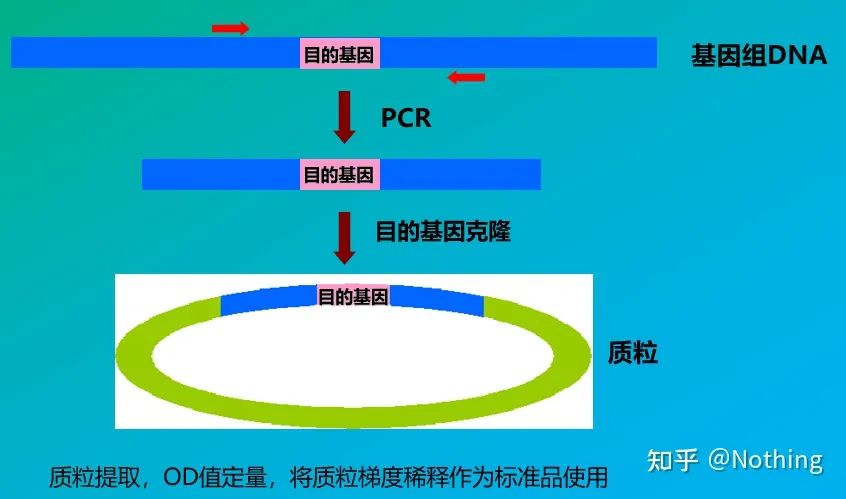
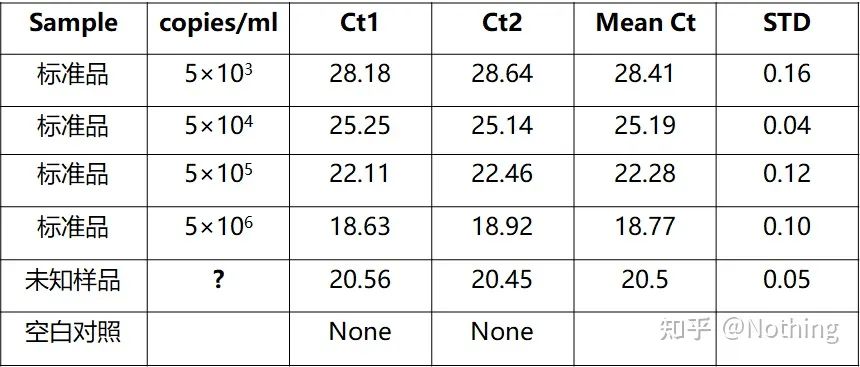
절대 정량화는 표준 곡선을 기반으로 해야 합니다.표준 곡선을 만들기 위해서는 표준이 필요합니다.일반적으로 표준은 표적 유전자를 복제하여 얻은 플라스미드입니다.왜 플라스미드인가?원형 플라스미드 DNA가 가장 안정적이기 때문입니다.표준품은 2배율(10배 희석)에 따라 5~6배로 희석하고 희석할 때 균일성에 주의한다.Ct 값을 15-30 사이에 두십시오.
표준 준비
동시에 테스트할 샘플도 그에 따라 희석해야 하며(희석 계수 기억) Ct 값도 15-30 사이여야 합니다.표준 제품 + 테스트할 샘플을 함께 기계에 넣습니다.실행 후 표준물질로 표준곡선을 만들고 시험할 시료를 표준곡선으로 가져와서 농도를 계산하였다.
B형 간염 바이러스 HBV 정량법은 대표적인 절대 정량법으로 혈액 1ml에서 바이러스 복제수를 계산할 수 있다.
사본 수 계산
시험할 시료 농도(ng/ul) = OD260 × 50ug/ml × 희석배수
샘플 분자량 = 염기 수 × 324
검사할 시료의 카피수(copies/ul) = 검사할 시료의 농도/시료의 분자량 × 6 × 1014
사본 수의 계산 방법
위는 수량을 결정하는 계산 방법입니다.중학교를 졸업하면 풀 수 있는 수학 문제로, 수학 문제는 일반적으로 컴퓨터로 풀 수 있다.당신이 이해하지 못하는 경우에, 당신은 소통하기 위하여 올 수 있습니다.
상대 정량화
상대 정량화는 주로 과학 연구에 사용됩니다.혈액 1ml에 몇 개의 바이러스가 있고 이것이 DNA 바이러스입니다. 이것은 상대적으로 결정론적인 사건입니다. 혈액의 양을 결정할 수 있고 DNA 바이러스는 상대적으로 안정적입니다.그러나 잎에서 특정 유전자의 전사 사본 수를 비교하는 것은 어렵습니다. 잎의 크기, 무게 및 부드러움을 결정하기 어렵고 추출된 RNA의 양을 결정하기 어렵고 역전사 효율도 결정하기 어렵기 때문입니다.
따라서 상대 정량화는 요소를 도입해야 합니다.내부 참조 유전자 .
즉, 상대 정량화는 실제로 대상 유전자와 내부 참조 유전자 간의 비교입니다.동일 조직 및 동일 세포 내에서와 비교하여 샘플 크기, RNA 추출량, 역전사 효율 및 PCR 효율의 영향이 상대적으로 작습니다.샘플 크기가 작기 때문에 내부 참조 유전자와 대상 유전자가 모두 상대적으로 감소했습니다.그동안 균일성과 안정성을 강조해 온 이유다.
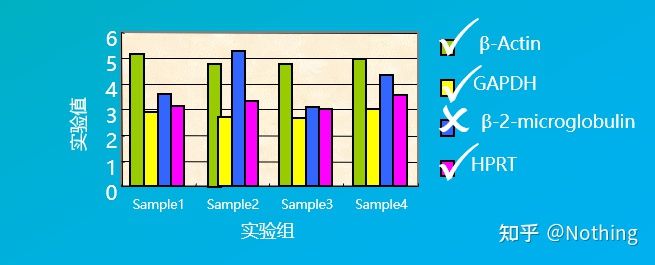
내부 참조 유전자는 일반적으로가사 유전자(하우스키핑 유전자) 모든 세포에서 안정적으로 발현되는 유전자 종류를 말하며, 그 산물은 세포의 기본 생명 활동을 유지하는 데 필요합니다.
이 개념을 혼동하지 마십시오.하우스키핑 유전자는 생물학적 기능 용어인 반면 내부 참조 유전자는 실험적 기술 용어입니다.하우스키핑 유전자는 검증을 통과해야 내부 참조 유전자로 선택될 수 있습니다.
예를 들어, 우리는 아래 그림에서 여러 하우스키핑 유전자를 선택하여 서로 다른 조직 세포에서 발현 수준을 테스트했으며, β-2-마이크로글로불린의 발현 수준이 다른 세 유전자의 발현 수준과 상당히 다르기 때문에 내부 참조 유전자로 사용할 수 없음을 발견했습니다.
내부 참조 유전자의 교정 기능을 이해한 후 내부 참조 유전자의 도입으로 인해 두 개의 알고리즘이 파생됩니다.
·이중표준곡선법
·2 – △△Ct 방식(CT값 비교 방식)
종 및 유전자 기능 연구에 관심이 있는 경우 알고리즘 연구를 포기하고 공식을 직접 사용하거나 기계를 직접 사용하십시오.당신이 수학과 공학에 이성애자라면 자유롭게 느끼십시오.
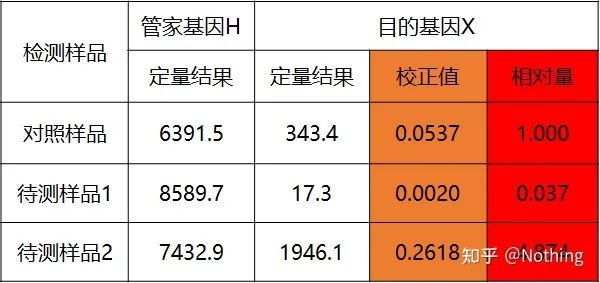
이중표준곡선법
표준곡선을 통해 대조시료와 검사대상시료의 표적유전자 및 하우스키핑유전자를 정량한 후 상대발현량인 계산식에 따라 상대값을 계산한다.
장점: 간단한 분석, 비교적 간단한 실험적 최적화
단점: 각 유전자에 대해 각 라운드의 실험에서 표준 곡선을 만들어야 합니다.
응용: 유전자 발현 조절 연구에서 가장 일반적으로 사용되고 인정되는 두 가지 상대 정량 방법 중 하나
공식은 다음과 같습니다.
예는 다음과 같습니다.
정량 결과에 따라 상대 금액 계산
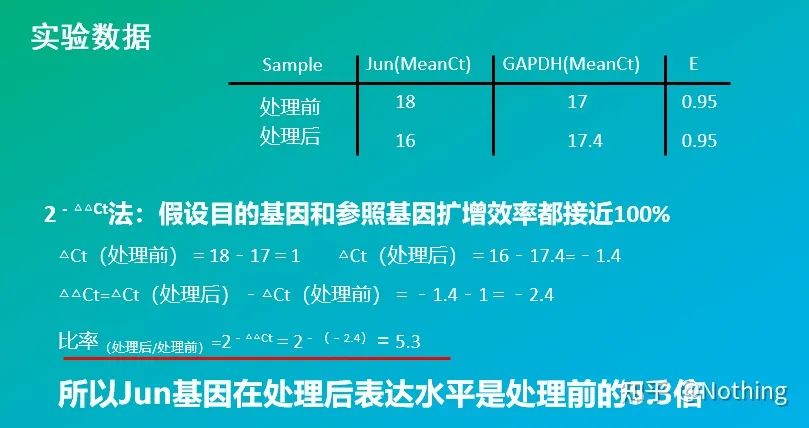
2 – △△Ct 방식(CT값 비교 방식)
장점: 표준 곡선을 만들 필요가 없습니다.
단점: 증폭 효율이 100%에 가깝다고 가정합니다.표준 편차는 5% 미만이고 표준 곡선과 각 증폭 사이의 효율성은 일관된 것으로 가정합니다.실험 조건의 최적화는 더 복잡합니다.
응용: 유전자 발현 조절 연구에서 가장 일반적으로 사용되고 인정되는 두 가지 상대 정량 방법 중 하나
물론 증폭 효율은 일반적으로 완벽하게 1이 되기는 불가능합니다. 보정 방법: target 유전자와 reference 유전자의 증폭 효율이 같다는 것을 알지만 증폭 효율이 1이 아닌 경우 2-△△Ct는 (1+E )-△△Ct로 보정할 수 있습니다.
지금까지 형광 정량적 PCR에 대한 내용은 끝이 났습니다.
게시 시간: 2023년 4월 6일